疫苗的免疫原性
国内外研究显示二价、四价和九价HPV疫苗在完成全程免疫接种后,均可观察到较高的疫苗相关型别抗体阳转率和血清学抗体滴度[1]。我国临床研究结果显示,9-17岁女性接种双价和四价HPV疫苗后免疫应答较强,血清学抗体滴度是18-26岁女性的1.42-3.00倍,而18-25岁女性与26-45岁女性抗体滴度相似[2]。
疫苗保护效力及安全性
双价人乳头瘤病毒吸附疫苗(Cervarix)
由葛兰素史克资助的名为“PATRICIA”的多国、双盲、随机对照实验,共纳入18644名15-25岁的健康女性(受试者加入研究前报告的性伴侣数量不超过6个,同意在疫苗接种期间采取避孕措施,且宫颈完好无损)。总接种队列(TVC)包括所有在第0、1和/或6个月接种过至少一剂疫苗的随机参与者(疫苗,n = 9,319 ;对照,n = 9,325 )。TVC-naïve组群(疫苗,n = 5,822;对照组,n = 5,819)指在基线时没有高危HPV感染的证据,与大多数HPV疫苗接种计划的目标少女相似[3]。
在TVC中,针对与HPV-16/18相关的宫颈上皮内瘤变1级或以上(CIN1+)、CIN2+和CIN3+的疫苗保护效力(VE)分别为55.5% (96.2%CI:43.2-65.3)、52.8% (96.2%CI:37.5-64.7)和33.6% (96.2%CI:-1.1-56.9)。在TVC-naïve组中,针对与HPV-16/18相关的CIN1+、CIN2+和CIN3+的VE分别为96.5% (96.2%CI:89.0-99.4)、98.4% (96.2%CI:90.4-100)和100% (96.2%CI:64.7-100)。预防12个月持续感染HPV-16/18的VE为89.9% (96.2%CI:84.0-94.0),预防HPV-31/33/45/51的VE为 49.0% (96.2%CI:34.7-60.3) [3]。在TVC-naïve组和TVC组中,疫苗对所有原位腺癌的VE分别为100%(95% CI: 31.0-100)和76.9%(95% CI: 16.0-95.8)[4]。
VIVIANE Ⅲ期双盲随机对照研究涵盖了来自12个国家的25岁以上健康女性,研究发现在疫苗接种的7年后,疫苗在预防HPV 6个月持续感染或HPV16/18型别导致的CIN1的保护效率为90.5%(96.2%CI:78.6-96.5),且对六个月持续感染HPV-31和HPV-45具有显著的交叉保护功效,疫苗组2877名女性中0.2%和对照组2870名女性中0.3%发生了与疫苗接种相关的严重不良事件[5]。
一项针对我国18-25岁健康女性开展的Ⅱ期/Ⅲ期临床研究的随访结果显示,随访72个月时,在最初HPV-16/18血清阴性/DNA阴性的女性中,双价人乳头瘤病毒吸附疫苗对HPV-16/18相关的CIN2+保护效力在协议疗效组群(ATP-E)为87.3%(95% CI: 5.5-99.7),总接种疗效组群(TCV-E)为88.7% (95% CI:18.5-99.7), 基线时无致癌HPV感染证据组群(TCV-naïve)为100% (95% CI:17.9-100)。随访57个月和随访72个月的结果显示,研究观察到的严重不良事件并不常见[6, 7]。
国产双价HPV疫苗(Cecolin)
一项涵盖了我国7372名18-45岁女性的多中心随机双盲对照研究的期中分析发现,经过42个月的随访,接种三针剂国产双价HPV疫苗(大肠杆菌)的受试者对于HPV-16/18相关的CIN 2/ CIN 3、原位腺癌或子宫颈癌的保护效力为100%,对生殖器HPV持续感染的保护效力为97.8%,研究未观察到与疫苗相关的严重不良事件,两种类型的中和抗体都可持续至少42个月[8]。
在接种后66个月随访也显示了疫苗耐受性良好,在按方案接种的易感人群中,疫苗对于预防与HPV-16和HPV-18相关的高级别生殖器病变的效力为100%(95%CI:67.2-100.0),对预防HPV-16和HPV-18的持续感染的效力为97.3% (95%CI: 89.9-99.7)。疫苗组(3691位参与者中的 267 位[7.2%])和对照组(3681位参与者中的 290 位[7.9%])的严重不良事件发生率相似,这些严重不良反应事件被认为与接种二价HPV疫苗无关[9]。
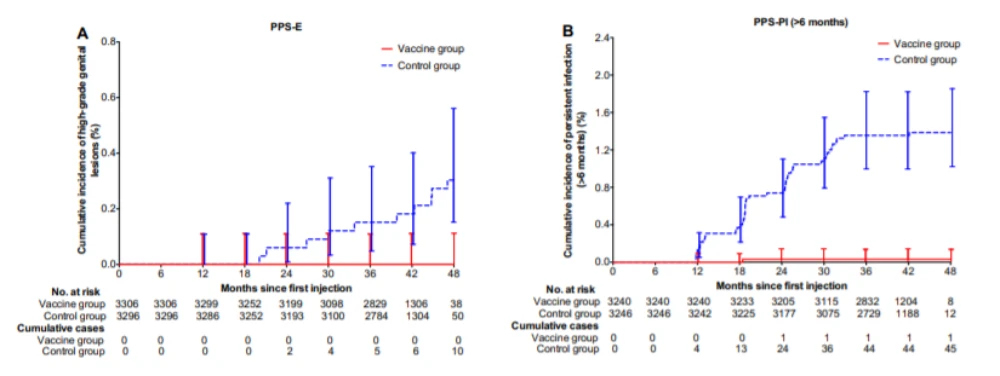
图片来源:Efficacy, Safety, and Immunogenicity of an Escherichia coli-Produced Bivalent Human Papillomavirus Vaccine: An Interim Analysis of a Randomized Clinical Trial
四价HPV疫苗 (Gardasil 4)
一项双盲、安慰剂对照试验纳入了13个国家共计12,167名15至26岁的女性(未怀孕、巴氏涂片结果无异常、过往性伴侣数量不超过四个),旨在评估四价HPV疫苗在预防与HPV-16/18型病毒相关的高级别宫颈病变方面的效果,主要复合终点为CIN2/3、原位癌或与HPV-16/18型病毒相关的宫颈癌。受试者接种第一剂疫苗或安慰剂后平均接受了三年的随访,疫苗预防主要复合终点的效力为98%(95.89% CI:86-100)[10]。
一项针对四项临床研究的综合分析评估了预防性接种四价HPV对CIN2/3以及AIS的影响。四项研究供纳入20,583名16-26岁女性,首次接种后的平均随访时间为三年,主要终点为HPV-16或HPV-18型病毒相关的CIN2/3、原位癌或宫颈癌的综合发病率。在疫苗接种期间HPV-16/18感染阴性的女性,疫苗对主要终点的效力为99%(95% CI: 93-100);对所有女性(包括感染了HPV-16/18的女性)进行的意向分析(ITT)显示,效力为44%;意向分析结果也显示,所有HPV型别导致的CIN2/3或原位癌的总发病率,降低了18%(95%CI: 7-29)[11]。一项在北欧四国(丹麦、冰岛、挪威和瑞典)进行的研究评估了接种四价HPV疫苗的长期效果,研究结果支持了疫苗保护作用可以维持至少10年[12]。
针对已感染了1-3种HPV病毒的妇女,接种四价HPV疫苗还可以预防其余HPV病毒引起的肿瘤[13]。此外,基于对三项随机临床试验的分析,预防性接种四价HPV疫苗还可以有效预防HPV-16/18感染引起的高级别外阴和阴道病变[14]。
在我国20-45岁女性中开展的临床研究对研究参与者随访了78个月,结果显示显示三针剂四价HPV疫苗对HPV-16/18相关CIN2/3、原位腺癌和子宫颈癌的保护效力为100%,该疫苗还降低了与HPV6、11、16、18相关的宫颈细胞学异常、有效率为94.0%[15]。此外,一项针对20-45岁中国女性开展的为期90个月的随机、双盲、安慰剂对照试验结果显示,接种四价HPV疫苗后的15天,疫苗接种组和安慰剂组在全身不良反应的发生率相似(46.8% 对 45.1%),注射部位的不良反应在疫苗组的发生率更高(37.6% 对 27.8%),接种组和安慰剂组分别有38名和43名参与者报告了严重不良反应,这些严重不良反应事件被认为与接种四价HPV疫苗不相关[16]。
九价HPV疫苗(Gardasil 9)
多个针对不同年龄、性别的临床研究验证了九价HPV疫苗的免疫原性和临床保护效力。
9-15岁人群:一项研究评估了接种九价HPV疫苗的长期免疫原性和有效性。研究纳入了1272名9-15岁青少年(女性,n=971; 男性,n=301),报告了接种九价HPV疫苗8年后的随访数据。接种了三针九价HPV疫苗的受试者,其体内每种HPV类型抗体的几何平均滴度(Geometric Mean Titers, GMT)在7个月时达到峰值,在7-90个月之间随时间的推移而降低;在接种的90个月后,每种HPV类型的抗体阳转率(Seropositivity rates)仍可以保持超过90%的水平(Luminex免疫测定法)。在随访的8.2年间,按试验方案接种的人群中没有观察到与HPV-6/11/16/18/31/33/45/52/58型别相关的高级别上皮内瘤变或生殖器疣病例[17]。其后的一项扩展研究显示,受试者在接种3剂九价HPV疫苗后11年(中位数为10年)后,受试者每种HPV类型的抗体阳转率(Seropositivity rates)保持超过81%的水平(Luminex免疫测定法),受试者中也未观察到与HPV-6/11/16/18/31/33/45/52/58型别相关的高级别上皮内瘤变或生殖器疣病例 [18]。
16-26岁人群:一项在18个国家105个研究中心开展的随机、双盲、效力、免疫原性和安全性临床研究,招募了14215名年龄在16-26岁的女性(无宫颈细胞学异常病史、过往性伴侣不超过4名),以1:1随机分配,接种三剂次四价或九价疫苗;主要结果为高级别宫颈疾病、外阴疾病和阴道疾病的发病率。研究结果显示,在预防4种共有HPV亚型方面,九价疫苗和四价疫苗具有相似的效力,而九价疫苗在预防其针对HPV-31/33/45/52/58亚型相关的高级别宫颈上皮内瘤变、阴道上皮内瘤样病变、外阴癌和阴道癌的效力达96.7%(95%CI: 80.9-99.8),但接种了九价HPV疫苗的在接种部位观察到的不良反应的比例较高 [19]。综合了两项国际研究中亚洲女性(来自印度、中国香港、韩国、日本、中国台湾和泰国)的数据显示,九价HPV疫苗在预防与HPV-31/33/45/52/58亚型相关的持续感染的效力为90.4%-100%[20]。同时,疫苗效力在接种后随访的6年间保持在一定水平,在整个研究中接种了九价疫苗的研究参与者观察到4例严重不良事件,与接种四价疫苗组相当[21]。
27-45岁人群:近期发表的一项涵盖了多国1212名健康女性的临床Ⅲ期随机对照试验验证了27-45岁女性与16-26岁女性在接种三针剂9价HPV疫苗后抗HPV16、18、31、33、45、52、58的中和抗体几何平均滴度非劣效性的假设。对于所有HPV型别,27-45岁的女性在第7个月(注:即第一剂疫苗接种后的七个月)血清阳转率超过99%,27-45岁女性中观察到注射部位和疫苗相关全身性不良事件的发生率分别为85.2%和24.1%,没有报告与疫苗相关的严重不良事件[22]。
中国女性人群:一项三期、非随机、开放标签的临床试验,评估了九价HPV疫苗在中国9-45岁女性人群中的免疫原性和安全性。1990名受试者中(9-19岁 690人,20-26岁650人,27-45岁650人)接种了三剂次九价HPV疫苗,并比较三组人群在第三剂疫苗接种后一个月的抗体血清阳转率与接种前的水平。研究结果显示,与20-26岁组女性相比,9-19岁和27-45岁组女性的血清阳转率非劣效。9-19岁、20-26岁和27-45岁组的受试者中,分别有43.3%、50.5%和43.8%的人报告了注射部位异常反应;此外,三组中还分别有50.9%、57.1%和43.4%的人报告了全身性的不良反应[23]。
国产九价HPV疫苗(Cecolin 9,尚未正式获批上市)
一项在中国进行的单中心、随机、单盲三期临床试验,招募了553名18-26岁女性,以8人一组的方式1:1随机分配,接种Cecolin-9或Gardasil 9两种不同九价HPV疫苗,并进行了头对头的免疫原性比较。研究结果显示,与接种了Gardasil 9相比,Cecolin 9诱导的HPV亚型特异性免疫反应不劣效于Gardasil 9[24]。
特殊人群保护效力
男性
Cochrane综述发现有中等质量证据表明在10-26岁男性中接种了四价HPV疫苗的与对照组相比减少了外生殖器病变的发生率和肛门生殖器疣的发生率[25]。在日本开展的随机对照研究发现,四价HPV疫苗对于HPV6、11、16、18的感染的保护效力达85.9%,虽然血清抗体阳性率在7-36个月之间降低,但在接种36个月后大部分接种者仍然保持一定的抗体转阳率和血清学抗体滴度[26]。在芬兰开展的基于社区的随机对照研究表明,男童HPV疫苗的高覆盖率可以为未接种疫苗的女性带来公共卫生益处[27]。
HIV阳性人群
一项系统性综述回顾了针对HIV感染者的HPV疫苗接种情况的研究,该综述发现HIV感染女性接种双价或四价HPV疫苗是安全的,且具有免疫原性[28]。针对南非18-25岁HIV感染女性的研究发现接种二价HPV疫苗后的的免疫反应不受CD4 T细胞计数和HIV病毒载量的影响[29]。在美国、巴西和南非开展的针对319名13-45岁HIV感染女性的研究发现,接种四价HPV疫苗对于CD4 T细胞>200 cells/mm3 人群,针对HPV四个亚型(6,11,16,18)的抗体应答率为85-100%,CD4 T细胞<=200 cells/mm3者的抗体应答率为75%-93%[30]。
不同接种程序的效力
单剂次接种
2022年,世界卫生组织免疫战略咨询专家组(SAGE) 在审议了过去几年单剂次HPV疫苗接种的研究证据后,认为单剂次HPV疫苗接种方案与两剂或三剂方案的效果相当。世界卫生组织因此更新了HPV疫苗立场文件,建议针对9-14岁女童(最优先人群)采用一剂次或两剂次的接种方案;针对15-20岁女童和女性采用一剂次或两剂次的接种方案;21岁以上的女性采用两剂次接种方案,间隔6个月[31]。
自2018年以来,由帕斯适宜卫生科技组织(PATH)协调组织的单剂次HPV疫苗评估联盟收集了来自临床试验、观察性研究和建模分析的数据[32],迄今为止累积的证据支持了HPV疫苗单剂次接种的免疫程序,且能够降低9-14岁女孩和15-20岁年轻女性为主要目标人群的宫颈癌前病变和癌症的发病率。
一项在哥斯达黎加开展的研究(The CVT Trial)对比了18-25岁女性在接种一剂、两剂或三剂二价HPV疫苗(Cervarix)后的近11.3年,在高危HPV16/18感染率方面的差异。研究发现对HPV16/18的疫苗效力在接种三剂疫苗女性中为80.2%(95% CI = 70.7%-87.0%),接种两针的女性中为83.8% (95% CI = 19.5%-99.2%),而仅完成一阵接种的女性中为82.1% (95% CI = 40.2%-97.0%)。虽然仅接种一针剂的女性抗体水平相对其他组较低,但随着时间的变化,接种不同剂量的女性的抗体水平趋于平稳,仅接种一针剂仍对于预防HPV感染有作用[33]。另外一项在印度开展的研究也证实了,在10-18岁女性中,仅接种1剂四价HPV疫苗,在10年之后对于预防HPV16、18亚型持续感染的效力为95.4%(95% CI: 85.0-99.9)[34]。
近期发表的两项临床随机对照试验(肯尼亚KEN SHE和坦桑尼亚DoRIS试验)的数据也进一步支持了HPV疫苗单剂次接种的程序。KEN SHE作为一项多中心、随机、双盲、对照试验,招募了2275名15-20岁的健康女性,她们被随机分配接种二价(n= 760)、九价(n= 758)或对照组(n= 757)疫苗,
接种单剂次二价或九价疫苗三年后,疫苗对于预防HPV持续感染仍具有极高的效力,其中九价疫苗为98.8%(95% CI:91.3-99.8),二价疫苗为97.5%(95% CI:90.0-99.4)[35]。
坦桑尼亚DoRIS试验是一项开放标签、随机、三期、非劣效试验,受试者为1002名9-14岁健康女孩,她们被随机分配接种1、2、3剂次二价HPV疫苗,或1、2、3剂次的九价HPV疫苗。研究结果显示,相比于两剂次和三剂次的接种组,两种HPV疫苗的单剂次接种组,在24个月时的HPV-16抗体血清阳转率的非劣效性符合要求,即便采用更严格的置信区间,非劣效性也符合要求;虽然抗HPV-18抗体的血清阳转率未达到非劣效性,但两种疫苗单剂次接种组中至少有98%的女孩在24个月时HPV-18抗体呈呈阳性[36]。
两剂次与三剂次接种程序对比
Cochrane review显示有中等到高强度的证据证明,在随访5年内,两剂型和三剂型HPV疫苗接种后在9-15岁女孩人群组的抗体反应相似,对于不良反应差异的数据有限[25]。一项在15个国家开展的多中心研究对比了在接种两剂九价HPV疫苗后的9-14岁女孩和男孩与接种三剂HPV疫苗的16-26岁女性的抗体情况,研究发现,在接种最后一剂疫苗的4周后,接种两剂疫苗的女孩和男孩的抗体反应不劣于接种三剂疫苗的青春期女孩和年轻女性[37]。
疫苗注射间隔
综述回顾了4项随机对照试验表明,有中到高强度的证据证明在三年的随访时间内,头两针注射HPV疫苗之间的间隔较长(6或12个月)的9-14岁儿童的抗体反应要强于间隔较短的抗体反应(2或6个月),目前没有随机对照试验收集临床相关结局证据,对于严重不良事件的证据质量较低[25]。
安全性
2017年WHO发布的HPV疫苗立场文件指出,现有证据表明目前已上市的HPV疫苗安全性良好 [31]。主要的不良反应表现为注射部位的轻度或一过性的局部反应(包括红斑、疼痛或肿胀)。2018年,一项基于109项研究,涉及6个国家250多万名接种者的回顾性文献显示,目前已上市的二价HPV疫苗 Cervarix、四价HPV疫苗(Gardasil 4)和九价HPV疫苗(Gardasil 9)的安全性均可接受,九价HPV疫苗的注射部位不良反应略高于四价HPV疫苗;没有一致的证据表明任何特殊关注不良事件(AESI)的风险会增加[38]。虽然相关资料有限,未观察到在孕期妇女、HIV阳性儿童中接种疫苗后出现严重不良反应结局,但在这些人群中开展接种仍需慎重[39]。
审核校对:陈姝、潘张旸、邓添艺、祖嘉琦、蒋梦露
页面编辑:祖嘉琦
参考文献:
- 中华医学会妇科肿瘤学分会, 中国优生科学协会阴道镜和宫颈病理学分会: 人乳头瘤病毒疫苗临床应用中国专家共识. 中国医学前沿杂志 2021, 13(2):1-12.
- Zhu F, Li J, Hu Y, Zhang X, Yang X, Zhao H, Wang J, Yang J, Xia G, Dai Q: Immunogenicity and safety of the HPV-16/18 AS04-adjuvanted vaccine in healthy Chinese girls and women aged 9 to 45 years: results from 2 randomized controlled trials. Human vaccines & immunotherapeutics 2014, 10(7):1795-1806.
- Apter D, Wheeler CM, Paavonen J, Castellsagué X, Garland SM, Skinner SR, Naud P, Salmerón J, Chow S-N, Kitchener HC: Efficacy of HPV-16/18 AS04-adjuvanted vaccine against cervical infection and precancer in young women: final event-driven analysis of the randomised, double-blind PATRICIA trial. Clinical and Vaccine Immunology 2015.
- Lehtinen M, Paavonen J, Wheeler CM, Jaisamrarn U, Garland SM, Castellsagué X, Skinner SR, Apter D, Naud P, Salmerón J: Overall efficacy of HPV-16/18 AS04-adjuvanted vaccine against grade 3 or greater cervical intraepithelial neoplasia: 4-year end-of-study analysis of the randomised, double-blind PATRICIA trial. The lancet oncology 2012, 13(1):89-99.
- Wheeler CM, Skinner SR, Del Rosario-Raymundo MR, Garland SM, Chatterjee A, Lazcano-Ponce E, Salmerón J, McNeil S, Stapleton JT, Bouchard C et al: Efficacy, safety, and immunogenicity of the human papillomavirus 16/18 AS04-adjuvanted vaccine in women older than 25 years: 7-year follow-up of the phase 3, double-blind, randomised controlled VIVIANE study. Lancet Infect Dis 2016, 16(10):1154-1168.
- Zhu FC, Chen W, Hu YM, Hong Y, Li J, Zhang X, Zhang YJ, Pan QJ, Zhao FH, Yu JX et al: Efficacy, immunogenicity and safety of the HPV-16/18 AS04-adjuvanted vaccine in healthy Chinese women aged 18-25 years: results from a randomized controlled trial. Int J Cancer 2014, 135(11):2612-2622.
- Zhu FC, Hu SY, Hong Y, Hu YM, Zhang X, Zhang YJ, Pan QJ, Zhang WH, Zhao FH, Zhang CF et al: Efficacy, immunogenicity and safety of the AS04-HPV-16/18 vaccine in Chinese women aged 18-25 years: End-of-study results from a phase II/III, randomised, controlled trial. Cancer Med 2019, 8(14):6195-6211.
- Qiao YL, Wu T, Li RC, Hu YM, Wei LH, Li CG, Chen W, Huang SJ, Zhao FH, Li MQ et al: Efficacy, Safety, and Immunogenicity of an Escherichia coli-Produced Bivalent Human Papillomavirus Vaccine: An Interim Analysis of a Randomized Clinical Trial. J Natl Cancer Inst 2020, 112(2):145-153.
- Zhao, F. H., Wu, T., Hu, Y. M., Wei, L. H., Li, M. Q., Huang, W. J., … & Xia, N. S. (2022). Efficacy, safety, and immunogenicity of an Escherichia coli-produced human papillomavirus (16 and 18) L1 virus-like-particle vaccine: end-of-study analysis of a phase 3, double-blind, randomised, controlled trial. The Lancet Infectious Diseases, 22(12), 1756-1768.
- FUTURE II Study Group (2007). Quadrivalent vaccine against human papillomavirus to prevent high-grade cervical lesions. The New England journal of medicine, 356(19), 1915–1927. https://doi.org/10.1056/NEJMoa061741
- Ault, K. A., & Future II Study Group (2007). Effect of prophylactic human papillomavirus L1 virus-like-particle vaccine on risk of cervical intraepithelial neoplasia grade 2, grade 3, and adenocarcinoma in situ: a combined analysis of four randomised clinical trials. Lancet (London, England), 369(9576), 1861–1868. https://doi.org/10.1016/S0140-6736(07)60852-6
- Kjaer SK, Nygård M, Dillner J, Brooke Marshall J, Radley D, Li M, Munk C, Hansen BT, Sigurdardottir LG, Hortlund M et al: A 12-Year Follow-up on the Long-Term Effectiveness of the Quadrivalent Human Papillomavirus Vaccine in 4 Nordic Countries. Clin Infect Dis 2018, 66(3):339-345.
- FUTURE II Study Group (2007). Prophylactic efficacy of a quadrivalent human papillomavirus (HPV) vaccine in women with virological evidence of HPV infection. The Journal of infectious diseases, 196(10), 1438–1446. https://doi.org/10.1086/522864
- Joura, E. A., Leodolter, S., Hernandez-Avila, M., Wheeler, C. M., Perez, G., Koutsky, L. A., Garland, S. M., Harper, D. M., Tang, G. W., Ferris, D. G., Steben, M., Jones, R. W., Bryan, J., Taddeo, F. J., Bautista, O. M., Esser, M. T., Sings, H. L., Nelson, M., Boslego, J. W., Sattler, C., … Paavonen, J. (2007). Efficacy of a quadrivalent prophylactic human papillomavirus (types 6, 11, 16, and 18) L1 virus-like-particle vaccine against high-grade vulval and vaginal lesions: a combined analysis of three randomised clinical trials. Lancet (London, England), 369(9574), 1693–1702. https://doi.org/10.1016/S0140-6736(07)60777-6
- Wei L, Xie X, Liu J, Zhao Y, Chen W, Zhao C, Wang S, Liao X, Shou Q, Qiu Y et al: Efficacy of quadrivalent human papillomavirus vaccine against persistent infection and genital disease in Chinese women: A randomized, placebo-controlled trial with 78-month follow-up. Vaccine 2019, 37(27):3617-3624.
- Chen W, Zhao Y, Xie X, Liu J, Li J, Zhao C, Wang S, Liao X, Shou Q, Zheng M et al: Safety of a quadrivalent human papillomavirus vaccine in a Phase 3, randomized, double-blind, placebo-controlled clinical trial among Chinese women during 90 months of follow-up. Vaccine 2019, 37(6):889-897.
- Olsson SE, Restrepo JA, Reina JC, Pitisuttithum P, Ulied A, Varman M, Van Damme P, Moreira ED, Jr., Ferris D, Block S et al: Long-term immunogenicity, effectiveness, and safety of nine-valent human papillomavirus vaccine in girls and boys 9 to 15 years of age: Interim analysis after 8 years of follow-up. Papillomavirus Res 2020, 10:100203.
- Restrepo, J., Herrera, T., Samakoses, R., Reina, J. C., Pitisuttithum, P., Ulied, A., Bekker, L. G., Moreira, E. D., Olsson, S. E., Block, S. L., Hammes, L. S., Laginha, F., Ferenczy, A., Kurman, R., Ronnett, B. M., Stoler, M., Bautista, O., Gallagher, N. E., Salituro, G., Ye, M., … Luxembourg, A. (2023). Ten-Year Follow-up of 9-Valent Human Papillomavirus Vaccine: Immunogenicity, Effectiveness, and Safety. Pediatrics, 152(4), e2022060993. https://doi.org/10.1542/peds.2022-060993
- Joura, E. A., Giuliano, A. R., Iversen, O. E., Bouchard, C., Mao, C., Mehlsen, J., … & Luxembourg, A. (2015). A 9-valent HPV vaccine against infection and intraepithelial neoplasia in women. New England Journal of Medicine, 372(8), 711-723.
- Garland SM, Pitisuttithum P, Ngan HYS, Cho CH, Lee CY, Chen CA, Yang YC, Chu TY, Twu NF, Samakoses R et al: Efficacy, Immunogenicity, and Safety of a 9-Valent Human Papillomavirus Vaccine: Subgroup Analysis of Participants From Asian Countries. The Journal of Infectious Diseases 2018, 218(1):95-108.
- Huh WK, Joura EA, Giuliano AR, Iversen O-E, de Andrade RP, Ault KA, Bartholomew D, Cestero RM, Fedrizzi EN, Hirschberg AL et al: Final efficacy, immunogenicity, and safety analyses of a nine-valent human papillomavirus vaccine in women aged 16–26 years: a randomised, double-blind trial. The Lancet 2017, 390(10108):2143-2159.
- Joura EA, Ulied A, Vandermeulen C, Rua Figueroa M, Seppä I, Hernandez Aguado JJ, Ahonen A, Reich O, Virta M, Perino A et al: Immunogenicity and safety of a nine-valent human papillomavirus vaccine in women 27–45 years of age compared to women 16–26 years of age: An open-label phase 3 study. Vaccine 2021, 39(20):2800-2809.
- Lv, H., Wang, S., Liang, Z., Yu, W., Yan, C., Chen, Y., … & Chen, Z. (2022). Immunogenicity and safety of the 9-valent human papillomavirus vaccine in Chinese females 9–45 years of age: a phase 3 open-label study. Vaccine, 40(23), 3263-3271.
- Zhu, F. C., Zhong, G. H., Huang, W. J., Chu, K., Zhang, L., Bi, Z. F., Zhu, K. X., Chen, Q., Zheng, T. Q., Zhang, M. L., Liu, S., Xu, J. B., Pan, H. X., Sun, G., Zheng, F. Z., Zhang, Q. F., Yi, X. M., Zhuang, S. J., Huang, S. J., Pan, H. R., … Xia, N. S. (2023). Head-to-head immunogenicity comparison of an Escherichia coli-produced 9-valent human papillomavirus vaccine and Gardasil 9 in women aged 18-26 years in China: a randomised blinded clinical trial. The Lancet. Infectious diseases, 23(11), 1313–1322. https://doi.org/10.1016/S1473-3099(23)00275-X
- Bergman H, Buckley BS, Villanueva G, Petkovic J, Garritty C, Lutje V, Riveros‐Balta AX, Low N, Henschke N: Comparison of different human papillomavirus (HPV) vaccine types and dose schedules for prevention of HPV‐related disease in females and males. Cochrane Database of Systematic Reviews 2019(11).
- Mikamo H, Yamagishi Y, Murata S, Yokokawa R, Han SR, Wakana A, Sawata M, Tanaka Y: Efficacy, safety, and immunogenicity of a quadrivalent HPV vaccine in Japanese men: A randomized, Phase 3, placebo-controlled study. Vaccine 2019, 37(12):1651-1658.
- Lehtinen M, Söderlund‐Strand A, Vänskä S, Luostarinen T, Eriksson T, Natunen K, Apter D, Baussano I, Harjula K, Hokkanen M: Impact of gender‐neutral or girls‐only vaccination against human papillomavirus—Results of a community‐randomized clinical trial (I). International journal of cancer 2018, 142(5):949-958.
- Zizza A, Banchelli F, Guido M, Marotta C, Di Gennaro F, Mazzucco W, Pistotti V, D’Amico R: Efficacy and safety of human papillomavirus vaccination in HIV-infected patients: a systematic review and meta-analysis. Scientific Reports 2021, 11(1):4954.
- Denny L, Hendricks B, Gordon C, Thomas F, Hezareh M, Dobbelaere K, Durand C, Hervé C, Descamps D: Safety and immunogenicity of the HPV-16/18 AS04-adjuvanted vaccine in HIV-positive women in South Africa: a partially-blind randomised placebo-controlled study. Vaccine 2013, 31(48):5745-5753.
- Kojic EM, Kang M, Cespedes MS, Umbleja T, Godfrey C, Allen RT, Firnhaber C, Grinsztejn B, Palefsky JM, Webster-Cyriaque JY et al: Immunogenicity and safety of the quadrivalent human papillomavirus vaccine in HIV-1-infected women. Clin Infect Dis 2014, 59(1):127-135.
- WHO. (2022). Human papillomavirus vaccines: WHO position paper (2022 update). Wkly. Epidemiol. Rec., 97, 645-672.
- Review of the current published evidence for single-dose HPV vaccination. (n.d.). PATH. https://www.path.org/our-impact/resources/review-current-published-evidence-single-dose-hpv-vaccination/
- Kreimer AR, Sampson JN, Porras C, Schiller JT, Kemp T, Herrero R, Wagner S, Boland J, Schussler J, Lowy DR et al: Evaluation of Durability of a Single Dose of the Bivalent HPV Vaccine: The CVT Trial. JNCI: Journal of the National Cancer Institute 2020, 112(10):1038-1046.
- Sankaranarayanan R, Joshi S, Muwonge R, Esmy PO, Basu P, Prabhu P, Bhatla N, Nene BM, Shaw J, Poli URR: Can a single dose of human papillomavirus (HPV) vaccine prevent cervical cancer? Early findings from an Indian study. Vaccine 2018, 36(32):4783-4791.
- Barnabas, R.V., Brown, E.R., Onono, M.A. et al. Durability of single-dose HPV vaccination in young Kenyan women: randomized controlled trial 3-year results. Nat Med 29, 3224–3232 (2023). https://doi.org/10.1038/s41591-023-02658-0
- Watson-Jones, D., Changalucha, J., Whitworth, H., Pinto, L., Mutani, P., Indangasi, J., … & Baisley, K. (2022). Immunogenicity and safety of one-dose human papillomavirus vaccine compared with two or three doses in Tanzanian girls (DoRIS): an open-label, randomised, non-inferiority trial. The Lancet Global Health, 10(10), e1473-e1484.
- Iversen O-E, Miranda MJ, Ulied A, Soerdal T, Lazarus E, Chokephaibulkit K, Block SL, Skrivanek A, Azurah AGN, Fong SM: Immunogenicity of the 9-valent HPV vaccine using 2-dose regimens in girls and boys vs a 3-dose regimen in women. Jama 2016, 316(22):2411-2421.
- Phillips, A., Patel, C., Pillsbury, A., Brotherton, J., & Macartney, K. (2018). Safety of Human Papillomavirus Vaccines: An Updated Review. Drug safety, 41(4), 329–346. https://doi.org/10.1007/s40264-017-0625-z.
- Association GOSoCM: 人乳头瘤病毒疫苗临床应用中国专家共识. 中国医学前沿杂志 2021, 13(2):1-12.





