全球各国纳入免疫规划情况概述
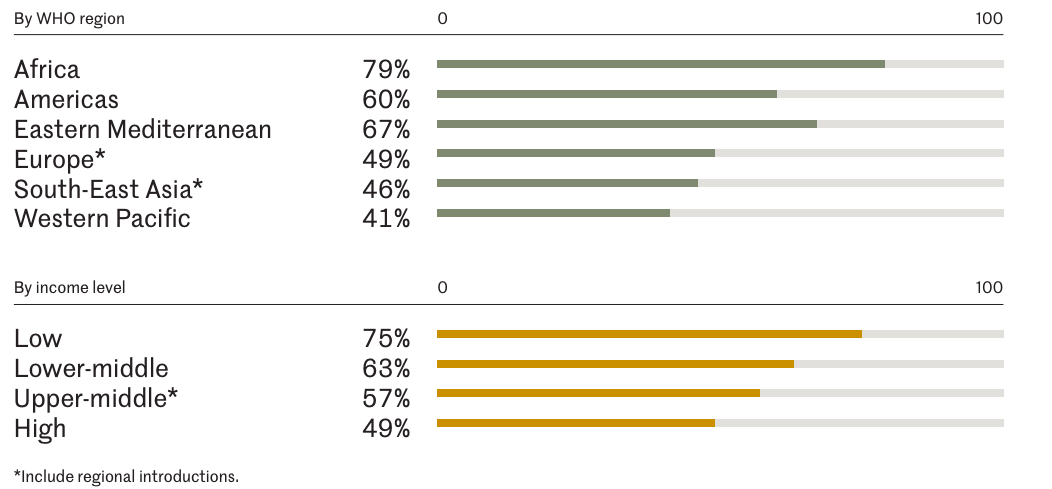
对于疫苗效力资料表明使用该疫苗有显著公共卫生效果、具备适宜的基础设施条件和筹资机制的国家,WHO强烈建议将轮状病毒疫苗纳入其国家免疫规划。根据ViewHub 统计,至2024年11月,全球共126个国家将RV疫苗纳入国家免疫规划 1。 截至2022,约7700万婴儿,即世界婴儿总数的57%,生活在已引入轮状病毒疫苗的国家或地区2。

中低收入国家主要通过Gavi 支持将轮状病毒疫苗纳入国家免疫规划。目前全球范围内57个符合Gavi资助条件的国家中有45个将轮状病毒疫苗纳入国家免疫规划3。截至2022年10月30日,世界卫生组织非洲区域的47个国家中有38个(占80%)已将轮状病毒疫苗纳入其国家免疫计划,其中超过30个国家为Gavi资助 。这38个国家中尼日利亚、刚果、贝宁首次引入轮状病毒疫苗即为印度生产的疫苗(Rotavac或Rotasiil);受Rotateq撤出Gavi市场、冷链问题、采购成本问题等因素的影响,其他35个首次引入Rotateq或Rotarix的国家中有5个国家也已将疫苗转为来自印度的疫苗4。
在中等偏上收入国家中,将轮状病毒疫苗纳入免疫规划的比例低于中低收入国家,且目前未纳入的国家主要是不满足Gavi 资助条件的国家。高收入国家中约49%将轮状病毒疫苗纳入国家免疫规划,至2022 年,中等收入国家这一比例为57%,低收入和中低收入国家引入 RV 疫苗的比例分别为 75% 和 63%2。在非Gavi支持的国家中,有56个国家尚未将轮状病毒疫苗纳入其国家免疫规划3,占全球未纳入轮状病毒疫苗国家的80%。这些未纳入的国家主要集中在西太区、东南亚,其中东南亚地区由轮状病毒引起的疾病负担较重。
全球共有5860万儿童未被轮状病毒疫苗覆盖,其中约70%的儿童集中生活在仅10个国家中2。中国是人口大国,全球约29%的轮状病毒疫苗未覆盖儿童在中国,其次为尼日利亚(12%),印度尼西亚(8%),孟加拉国(5%),埃及(4%),菲律宾(4%),越南(3%,2023年越南在Gavi支持下开始分地区将轮状病毒疫苗纳入免疫规划5),伊朗(3%),土耳其(2%),苏丹(2%)。
各国轮状病毒疫苗推荐接种程序
欧美发达国家
欧美各国建议的最早接种时间一致,通常在婴儿6周龄开始。建议最晚接种第一针时间大多数为15周,少数国家如芬兰建议为12周,这些时间窗口确保婴儿在最易感时期内得到保护。建议最晚接种最后一针的时间各国有所不同,使用Rotarix的国家通常建议在6月龄(24周)前完成接种;使用RotaTeq的国家通常建议在8月龄(32周)之前完成接种(见表6.1)。
表6.1 部分欧美国家轮状病毒疫苗推荐接种程序
| 国家 | 疫苗种类及接种程序 | 建议最早可接种时间 | 建议最晚接种第一针时间 | 建议最晚接种最后一针时间 | 是否可以与其他免疫规划疫苗同时接种 |
| 美国 | Rotarix: 需接种2剂,2月龄、4月龄 RotaTeq: 需接种3剂,2月龄、4月龄和6月龄 (如果接种过程中任何剂次为RotaTeq或未知,默认采用3剂系列。) | 6 周 | 15 周 | 8月龄 | 是* |
| 加拿大 | Rotarix: 需接种2剂,2月龄、4月龄(两剂之间至少间隔4周) RotaTeq: : 需接种3剂,2月龄、4月龄和6月龄(间隔4-10周) | 6 周 | 15 周 | 8月龄 | 是 |
| 英国 | Rotarix: 需接种2剂,8周/2月龄,12周/3月龄(两剂之间至少间隔4周) | 6 周 | 15 周 | 24周 | 是 |
| 芬兰 | RotaTeq: 需接种3剂,2月龄、3月龄、5月龄(两剂之间至少间隔4周) | 6 周 | 12 周 | 32周/8月龄 | — |
| 法国 | Rotarix: 需接种2剂,2月龄、3月龄RotaTeq: 需接种3剂,2月龄、3月龄、4月龄 | 6 周 | — | Rotarix: 24周 RotaTeq: 32周 | 是 |
| 荷兰 | Rotarix/RotaTeq: 根据疫苗规定接种2-3剂 | 6 周 | 12 周 | 24 周 | 是 |
| 挪威 | Rotarix: 需接种2剂,6周、3月龄 | 6 周 | 12 周 | 16 周 | — |
注:*可以与DTaP 疫苗、Hib 疫苗、乙型肝炎疫苗和肺炎球菌结合疫苗等在同一次就诊期间安全接种。(数据来源:Vaxlab团队根据公开资料整理)
西太区、东南亚国家和地区
西太区、东南亚仅有部分国家将轮状病毒疫苗纳入国家免疫规划,包括澳大利亚、新西兰、日本、越南、泰国(见表6.2)。包括中国(含香港、澳门)在内的十余个国家均未将轮状病毒疫苗纳入国家免疫规划。
表6.2 部分西太区及东南亚国家轮状病毒疫苗推荐接种程序
| 国家 | 疫苗种类及接种程序 | 建议最早可接种时间 | 建议最晚接种第一针时间 | 建议最晚接种最后一针时间 | 是否可以与其他免疫规划疫苗同时接种 |
| 澳大利亚 | Rotarix: 需接种2剂,2月龄、4月龄 (两剂之间至少间隔4周) | 6周 | 14周零6天 | 24周零6天 | 是 |
| 新西兰 | Rotarix: 需接种2剂,6周、3月龄 (两剂之间至少间隔4周)发生过轮状病毒肠炎的婴儿仍建议完成接种 | 6周 | 14周零6天 | 24周零6天 | 是 |
| 日本 | Rotarix: 需接种2剂,2月龄、3月龄 RotaTeq: 需接种3剂,2月龄、3月龄和4月龄 | 6周 | 14周零6天 | Rotarix: 24周 RotaTeq: 32周 | — |
| 越南 | Rotavin-M1: 需接种2剂,两剂之间间隔约2个月 | 6周 | — | 6月龄 | — |
| 泰国 | RotaTeq: 需接种3剂,2月龄、4月龄和6月龄 | — | — | — | — |
(数据来源:Vaxlab团队根据公开资料整理)
将轮状病毒疫苗纳入免疫规划的积极影响
部分将轮状病毒疫苗纳入其免疫计划的国家发现轮状病毒疫苗的效果极为显著,甚至超过预期。在澳大利亚(图1)、奥地利(图2)、美国(图3)等高收入国家,轮状病毒疫苗显著减少了5岁以下儿童因轮状病毒感染而住院的病例数,降幅达到45%至94% 5–10。此外,这一年龄组因腹泻住院的总体数量也减少了25%至54%。同样,拉丁美洲国家的腹泻住院率也有所下降,降幅在13%至48%之间11。
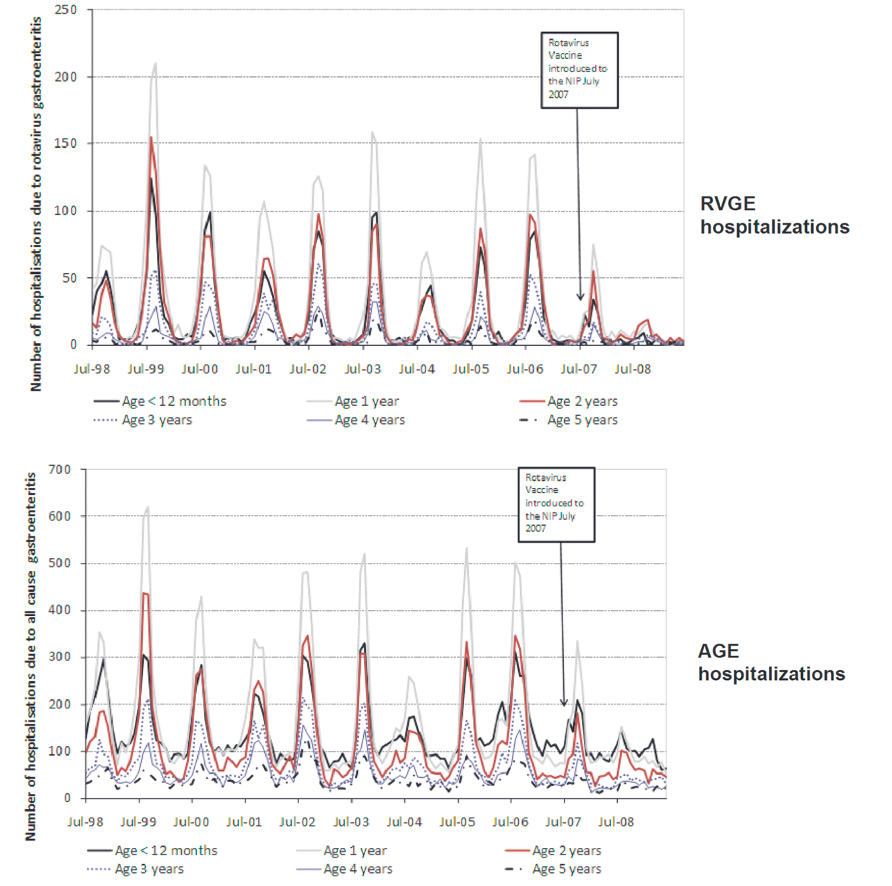
图片来源:Pendleton, A. et al. Impact of rotavirus vaccination in Australian children below 5 years of age. Hum Vaccin Immunother 9, 1617–1625 (2013).
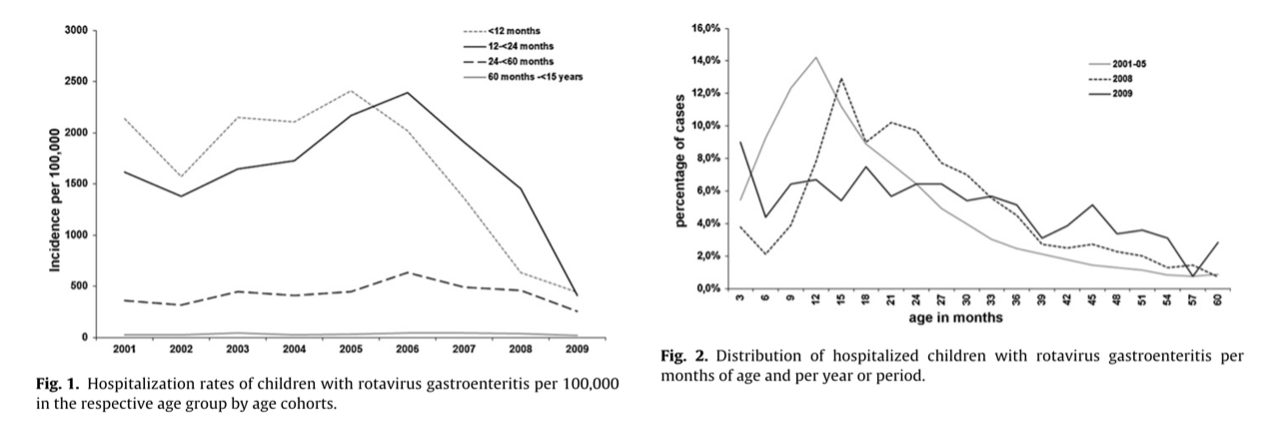
来源:https://www.sciencedirect.com/science/article/pii/S0264410X11001769?via%3Dihub#fig0005

图片来源:Direct and Indirect Effects of Rotavirus Vaccination Upon Childhood Hospitalizations in 3 US Counties, 2006–2009. https://academic.oup.com/cid/article/53/3/245/289062?login=true
亚洲国家也有同样的案例。在菲律宾进行的Rotarix试点引入中,随着疫苗接种覆盖率的提高,腹泻入院率也有所下降12。到第三年,当疫苗在试点省范围内提供并且两剂次覆盖率达到88%时,5岁以下儿童因腹泻住院的数量比疫苗引入前三年的平均年度病例数减少了63%。只有在2016年由于疫苗供应中断六个月而导致疫苗覆盖率下降时,腹泻住院率才开始再次上升。
泰国自2012年引进Rotarix (RV1) 和RotaTeq (RV5), 并于2020年纳入国家免疫规划(NIP)。泰国的一项研究比较了轮状病毒疫苗引入NIP之前的2015-2019六年中,以及引入NIP的2020年的RVGE就诊率, 住院率以及死亡情况。结果发现,轮状病毒疫苗纳入NIP的当年,婴儿腹泻相关的就诊率下降了17.8%,住院率下降了2.9%,病死率下降了20%13。 在拉美国家,阿根廷于 2015 年 1 月在国家免疫规划中引入了轮状病毒疫苗接种。在轮状病毒疫苗纳入国家免疫规划后的 3 年中,2 岁以下儿童的急性腹泻病例明显减少了 22.1%,因轮状病毒感染而住院的人数明显减少了 15.4% ;2岁和1岁儿童的报告轮状病毒感染病例分别大幅减少了54.0%和59.4%,同一年龄组的因轮状病毒感染而住院病例也分别减少了39.3%和40.8%11。
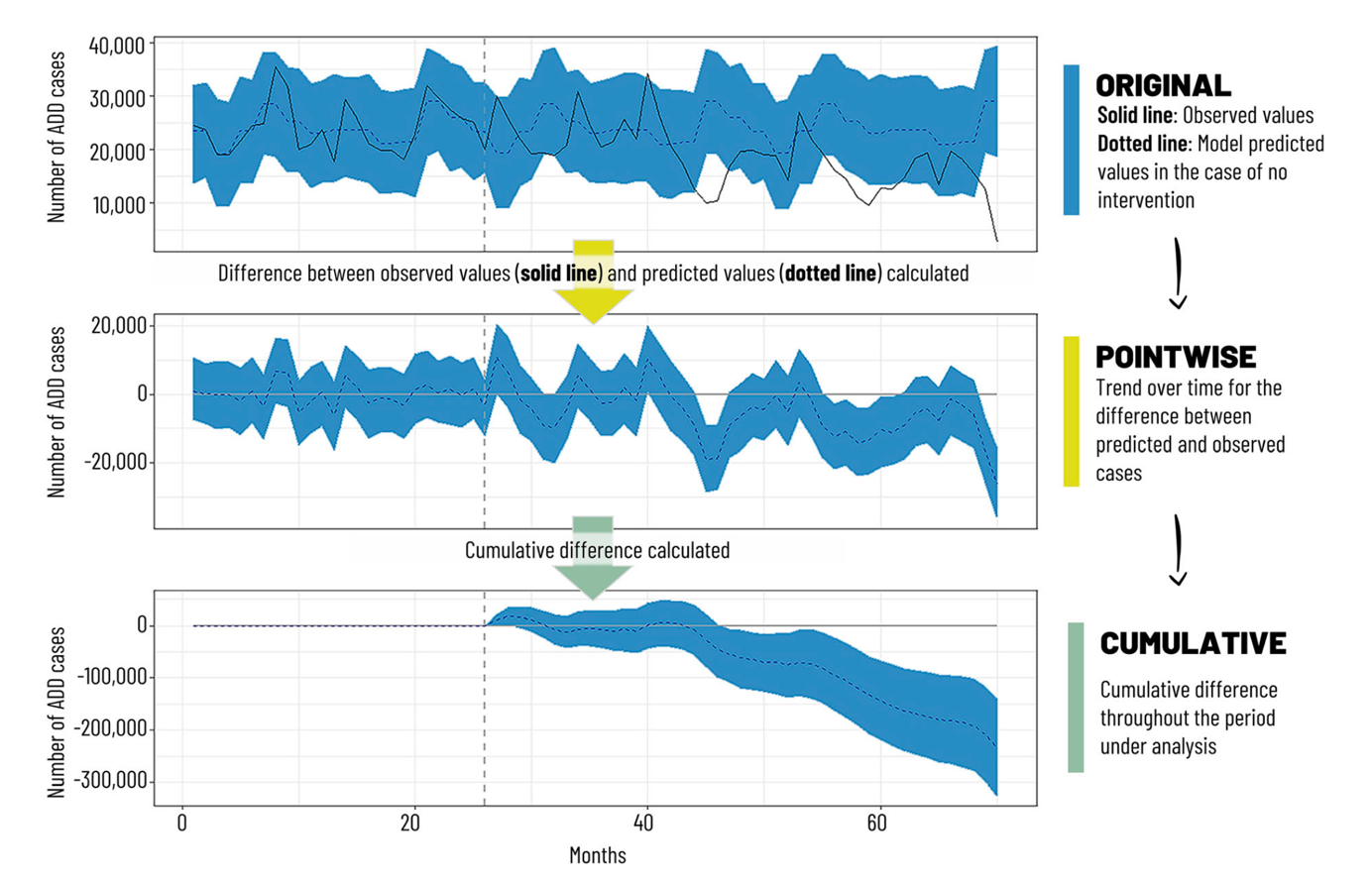
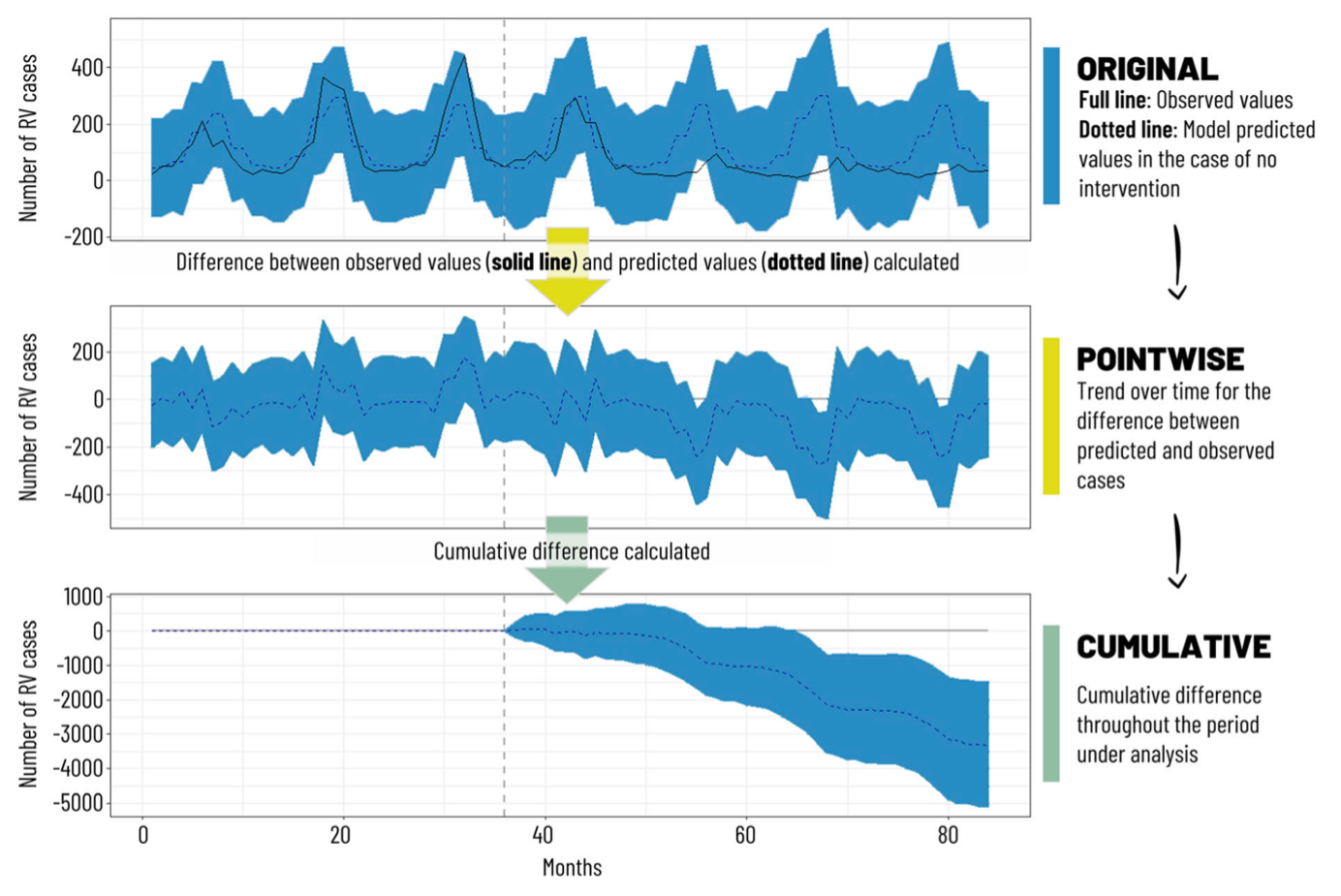
一项回顾墨西哥轮状病毒疫苗纳入NIP15年经验的系统综述显示,墨西哥在2006-2011年间在NIP中采用二剂次的Rotarix疫苗,自2011年起NIP又引入三剂次的RotaTeq疫苗。对轮状病毒疫苗纳入NIP期间所有相关研究的综述结果表明,2006年前3岁以下儿童中59%(2003年)的胃肠炎由轮状病毒引起。轮状病毒疫苗引入后在预防当地儿童轮状病毒胃肠炎中具有良好的功效和利益风险比(4项研究发现,Rotarix预防严重RVGE和所有RVGE的功效分别是70%-100%和70%-80%),实际应用效果是降低了5岁以下儿童由腹泻导致的死亡(下降了43%-55%)、住院(预防任何RVGE的功效是42%,预防重症的功效为85%),和新发病例数(相比2006,2008-2017期间下降了15.5%-46%),综述认为,轮状病毒疫苗在墨西哥使用大幅度降低了5岁以下儿童的腹泻疾病负担,具有较好的成本效果14。
此外,有系统综述发现轮状病毒疫苗可以减少抗生素处方需求,有助于缓解抗生素耐药性问题15。有研究估计,当前的轮状病毒疫苗接种覆盖率可减少中低收入国家1360万例5岁以下儿童中接受抗生素治疗的病例16。自引入轮状病毒疫苗以来,印度5岁以下儿童因轮状病毒导致的抗生素滥用降低了21.8%(18.6–25.1%)17。但我国仍缺乏有关轮状病毒疫苗接种与抗生素使用的研究。
越南引入轮状病毒疫苗的案例
越南的轮状病毒疫苗引入经历了轮状病毒监测系统的建立、本土疫苗获批使用、引入两省进行常规免疫试点、安全性监测和试点效果评价、新疫苗研发、纳入国家免疫规划推广应用、从Gavi支持推广实施逐步过渡到本国财政全覆盖。
越南在引入轮状病毒疫苗之前就已经建立了以医院为基础的5岁以下儿童急性水样腹泻病例的轮状病毒监测,在疫苗引入前,监测发现的轮状病毒阳性比例在50%左右18。越南国产疫苗(POLYVAC, Hanoi, Vietnam) 2012年获批在越南本土使用,这款疫苗含G1P[8]病毒株, 为液态口服疫苗,每剂2毫升,需摄氏2-8度储存19。
越南于2017年12月在本国的两个试点省(Nam Dinh 和TT Hue)引入Rotavin-M1 作为预防轮状病毒的常规免疫,并对疫苗使用的安全性和效果开展监测研究。在安全性方面,6个监测医院的结果没有发现疫苗使用与肠套叠有关20。在覆盖面方面,Rotavin-M1 的覆盖率在Nam Dinh 省为77% (1066/1377) ,在TT Hue省为 42% (203/489);在有效性方面, Nam Dinh省的5岁以下儿童RV阳性率在三年试点期内下降了40.6% (95% CI: 34.8%–45.8%) ,但在TT Hue省没有发现轮状病毒阳性率的变化。在6-23月龄的儿童中,2剂次Rotavin-M1 疫苗在避免儿童因中重度腹泻住院方面的有效性为57%21。
越南第二代轮状病毒疫苗(Rotavin)临床试验证明其安全性有效性不亚于Rotavin-M1,没有肠套叠和死亡发生,可以作为推广应用的候选疫苗22。Rotavin已于2022年1月获批,并于2024年被批准纳入国家免疫规划。鉴于越南5岁以下儿童的轮状病毒疾病负担大,国内已具备生产相关疫苗的能力,且市场后研究发现本土生产的疫苗具有良好的免疫原性和安全性,越南国家免疫技术咨询委员会在经过多方咨询和与政府沟通的基础上,提出了越南引入轮状病毒疫苗的项目方案,经卫生部、财政部和总理审批,纳入2021-2025的国家免疫规划,以确保引入轮状病毒疫苗的资金预算。2022年,轮状病毒疫苗作为新疫苗引入国家免疫规划获得了总理批准后,2023年政府相关资金到位。2024年起,购买轮状病毒疫苗的资金20%来自Gavi(国际疫苗联盟购买Retarix /Rotavin),80%来自越南中央政府(购买本土生产的疫苗Rotavin);轮状病毒疫苗接种经费来自Gavi。2025年起,购买疫苗和实施接种的费用将全部来自越南中央政府。
越南轮状病毒疫苗的免疫规划主要针对1岁以下的婴儿,口服同款疫苗2剂次,中间间隔2-3月,第二代RV疫苗采用多阶段拓展覆盖面,基于公平和可持续原则,2024年先从偏远山区开始,国家预算覆盖32个省,Gavi资助覆盖4个省。2025年拓展到41个省,2026年覆盖全国23。
越南在将轮状病毒疫苗引入国家免疫规划的过程中的以下经验值得我国借鉴,一是利用轮状病毒监测系统数据客观展示本国疾病负担证据;二是以开发和使用本土疫苗为主,辅以进口疫苗;三是省级试点先行,获得本土疫苗大规模使用的覆盖面、安全性和有效性证据;四是持续不断的倡导各利益相关者,以消除疫苗纳入免疫规划的各种障碍;五是基于公平和可持续原则,通过分阶段引入和多途径筹资,逐步扩大疫苗在全国范围的应用。
参考文献
- VIEW-hub. Rotavirus vaccines. Accessed November 10, 2024. https://view-hub.org/vaccine/rota
- Johns Hopkins Bloomberg School of Public Health. (2022). Rotavirus Vaccine Introduction and Coverage. https://publichealth.jhu.edu/sites/default/files/2024-02/rota-brief1-introduction2022-1ax.pdf
- WHO Immunization Data portal – Detail Page. Immunization Data https://immunizationdata.who.int/global/wiise-detail-page
- Mandomando, I. et al. Lessons Learned and Future Perspectives for Rotavirus Vaccines Switch in the WHO African Region. Vaccines 11, 788 (2023).
- Ruiz-Palacios, G. M. et al. Safety and Efficacy of an Attenuated Vaccine against Severe Rotavirus Gastroenteritis. N Engl J Med 354, 11–22 (2006).
- Paulke-Korinek, M. et al. Sustained low hospitalization rates after four years of rotavirus mass vaccination in Austria. Vaccine 31, 2686–2691 (2013).
- Paulke-Korinek, M. et al. Herd immunity after two years of the universal mass vaccination program in Austria. Vaccine 29, 2791–2796 (2011).
- Buttery, J. P. et al. Reduction in Rotavirus-associated Gastroenteritis in Australia. Pediatr Infect Dis J 30, S25–S29 (2011).
- Pendleton, A. et al. Impact of rotavirus vaccination in Australian children below 5 years. Hum Vaccin Immunother 9, 1617–1625 (2013).
- Payne, D. C. et al. Direct and Indirect Effects of Rotavirus Vaccination in US Counties. Clin Infect Dis 53, 245–253 (2011).
- Marti, S. G. et al. Rotavirus Vaccine Impact in Argentina. Infect Dis Ther 12, 513–526 (2023).
- Lopez, A. L. et al. Impact of rotavirus vaccine in the Philippines. Vaccine 36, 3308–3314 (2018).
- Charoenwat, B. et al. Rotavirus vaccine impact in Thailand. BMC Public Health 23, 2109 (2023).
- Guzman-Holst, A. et al. 15-year experience with rotavirus vaccination in Mexico: A systematic review. Hum Vaccin Immunother 17, 3623–3637 (2021).
- Simhachalam Kutikuppala, L. V. et al. Impact of rotavirus vaccination on antibiotic use. World J Virol 13(2), 92586 (2024).
- Lewnard, J. A. et al. Childhood vaccines and antibiotic use in LMICs. Nature 581, 94–99 (2020).
- Gleason, A. et al. Rotavirus vaccine and antibiotic use in India: A simulation study. Vaccine 42(22), 126211 (2024).
- Huyen DTT et al. Epidemiology of rotavirus diarrhea in Vietnam. Vaccine 36(51), 7894–900 (2018).
- Skansberg, A. et al. Product review: ROTASIIL, ROTAVAC, and Rotavin-M1. Hum Vaccin Immunother 17, 1223–1234.
- Le, L. K. T. et al. Intussusception surveillance in Vietnam pilot provinces. Vaccines (Basel) 12, 170 (2024).
- Van Trang, N. et al. Impact and effectiveness of Rotavin-M1 in Vietnam. Lancet Reg Health West Pac 37, 100789 (2023).
- Thiem, V. D. et al. Safety and immunogenicity of rotavirus vaccines in Vietnam. Vaccine 39, 4463–4470 (2021).
- Duong Thi Hong. The immunization of RV vaccine in Vietnam. Presented at the 5th International Workshop on Rotavirus and Norovirus, Shanghai, May 8–9, 2024.





