接种轮状病毒疫苗是目前预防轮状病毒感染最经济和有效的手段。2009年,世界卫生组织(World Health Organization, WHO)建议所有国家将口服轮状病毒疫苗纳入常规免疫规划中1。据已有研究显示,目前上市的轮状病毒疫苗均具有较好的安全性,不同的轮状病毒疫苗在不同国家或地区的保护效果略有不同。总体上,轮状病毒疫苗在欧洲和美洲等发达国家中呈现较高的保护效力和保护效果,而在非洲和亚洲的一些发展中国家则略低2-4。
全球轮状疫苗概况
上市疫苗种类
目前全球已有七种RV疫苗上市5,6,包括Rotarix(比利时葛兰素史克公司)、RotaTeq(美国默沙东公司)、Rotavac(印度Bharat生物技术公司)、Rotasiil(印度血清研究所)、LLR(罗特威,中国兰州生物制品研究所)、LLR3(罗特威,中国兰州生物制品研究所)和Rotavin-M1(越南Polyvac公司),其中,RotaTeq、Rotarix、Rotavac和Rotasil已获得WHO预认证,LLR、LLR3和Rotavin-M1仅在部分国家获得上市许可(见表4.1)。截至2023年,共有75个国家使用Rotarix,24个国家使用RotaTeq,11个国家同时使用RotaTeq和Rotarix,11个国家使用Rotavac,6个国家使用Rotasiil,1个国家同时使用Rotasiil和Rotavac。此外,还有2个国家声明将引进轮状病毒疫苗,但尚未明确具体疫苗7。
表4.1 国内外上市RV疫苗概况
| 疫苗 | 研发公司 | 血清型/毒株 | 上市年份 | 免疫程序 | 规格 | 使用国家 |
| Rotarix | 比利时葛兰素史克公司 | G1P[8] | 2005 | 2 剂次,从 6 周龄开始,间隔 4 周,24 周龄时完成 | 1.5mL/剂,液体 | 75个国家 |
| RotaTeq | 美国默沙东公司 | G1, G2, G3, G4, P[8] | 2006 | 3 剂次,从 6-12 周龄开始,间隔 4-10 周,32 周龄时完成 | 2mL剂,液体 | 24个国家 |
| Rotavac | 印度Bharat生物技术公司 | G9P[11] | 2014 | 3 剂次,6 周龄开始,间隔 4 周, 8 月龄前完成 | 液体(冷冻)和非冷冻液体 | 11个国家 |
| Rotasiil | 印度血清研究所 | G1, G2, G3, G4, G9 | 2017 | 3 剂次,6 周龄开始,间隔 4 周, 1 岁内完成 | 2.5mL/剂,冻干;2mL/剂,液体 | 6个国家 |
| LLR | 中国兰州生物制品研究所 | G10P[15] | 2000 | 3 剂次,2 月龄-3 岁,每年服 1 剂 | 3mL/剂,液体 | 中国 |
| LLR3 | 中国兰州生物制品研究所 | G2, G3, G4 | 2023 | 3剂次,6-13周龄开始,间隔1月,第3剂不应晚于32周龄 | 2mL/剂,液体 | 中国 |
| Rotavin-M1 | 越南Polyvac公司 | G1P[8] | 2012 | 2 剂次,6 周龄开始,6 月龄完成, 至少间隔 1 月 | 2mL/剂,液体(冷冻)和非冷冻液体 | 越南 |
何莲花, 李金松, & 段招军. 中国轮状病毒疫苗有效性和安全性研究进展. 中国疫苗和免疫 29, 239–245 (2023)
图片来源:VIEW-hub
安全性、保护效力和保护效果
已有的研究证据表明,广泛使用的两种轮状病毒疫苗(Rotarix, RotaTeq) 在不同国家和地区的保护效力和效果存在差异。这可能与各国家或地区之间的经济水平、生活习惯、遗传背景、流行毒株等多种因素的差异有关5。目前已上市的轮状病毒疫苗均有良好的安全性,未见于疫苗相关的严重不良事件12-14,31-33。总体而言,轮状病毒疫苗在低死亡率地区(多为发达国家)的保护效力和效果较高,而在高死亡率地区则较低3,4。
RotaTeq疫苗在高死亡率地区保护效果低于低死亡率地区可能由如下原因导致:(1)在一些高死亡率地区,P[6]基因型是这些地区的主要流行优势株,RotaTeq疫苗未覆盖此基因型;(2)高死亡率地区经济水平低于低死亡率地区,轮状病毒疫苗接种未纳入国家免疫规划,疫苗覆盖率不足;(3)高死亡率地区在医疗卫生状况、营养状况等方面差于低死亡率地区。RVGE病程延长,重症及死亡率升高15。营养不良(锌缺乏、维生素AD缺乏)、肠道微生物、多重感染、婴儿免疫系统的不成熟/功能降低、环境性肠病、母源抗体(经胎盘或母乳)、遗传因素也有可能导致轮状病毒疫苗在不同国家的免疫效果不同16,35。此外,随着接种时间的推移,高死亡率地区的轮状病毒疫苗保护效力或效果下降更快17。
除此之外,还有证据表明在婴幼儿疫苗接种率较高的情况下,较为年长的人群也能获得一定的群体保护。这突显了随着疫苗项目的逐步建立,疫苗接种能够带来更大社会效益的潜力。提高疫苗接种覆盖率,并持续投资于广泛的轮状病毒疫苗接种项目,可能会增加与疫苗接种相关的公共健康收益,并进一步减少疾病带来的临床和经济负担30。
在我国上市的轮状病毒疫苗
口服五价重配轮状病毒减毒活疫苗(Vero细胞)
RotaTeq(即五价轮状病毒疫苗,RV5)是 2006 年 2 月美国批准上市的口服轮状病毒减毒活疫苗, 随后在欧洲多个国家使用,该疫苗由人‐牛(WC3)毒株重配的G1、G2、G3、G4 和P1A[8]五种型别轮状病毒重配株组成,其接种对象为6~32周龄婴儿,全程需服用3剂,出生后6~12周龄口服第1剂,每剂间隔4~10周,第3剂次不应晚于32周龄。该疫苗于2008年获得了世界卫生组织的预认证评审19,并于2018年在我国上市。根据上海疾控的数据,此疫苗在上海的采购价格为285.5元/剂次。
目前,IgA被认为是衡量轮状病毒疫苗免疫原性的最可接受的实验室参数,并且通常在临床试验中用作血清学的衡量标准。对自然轮状病毒感染和疫苗试验的研究表明,血清轮状病毒抗体与疫苗保护效果之间存在关联。国内一项随机对照临床试验表明RotaTeq抗轮状病毒的 IgA 血 清 阳 转 率 为 89. 4%18。另 一 项 临 床 试 验评 估了 RotaTeq的效力以及与其他疫苗联合接种的效力和安全性,结果显示 RotaTeq对由任何血清型引起的任何严重程度的RVGE的保护效力为 69. 3%,对任何血清型引起的严重程度的RVGE的保护效力为78.9%14。国内研究普遍发现接种三剂RotaTeq针对由轮状病毒引起的腹泻具有较高有效性。一项研究评估了上海幼儿接种三剂的RotaTeq有效性,研究发现接种3剂RotaTeq疫苗在14周至4岁儿童中的有效性为85%(95% CI:50%-95%),在14周至2岁儿童中达到97%(95% CI:83%-100%),主要针对G8P8、G9P8和G2P4基因型轮状病毒株,这三种基因型分别占流行毒株的78.95%、18.42%和2.63% 36。
北京地区的研究显示,接种三剂RotaTeq,对于预防A群轮状病毒感染引起的腹泻,保护效果为90.4% (95%CI: 28.8%-98.7%)37。
此外,一项基于成都地区的研究发现引入RotaTeq对于轮状病毒的传播遏制有显著作用:引入RotaTeq后轮状病毒整体流行季开始时间延迟、持续时间也由接种前的20周缩短至7周,且流行季的阳性率峰值显著降低 38。RotaTeq 在2018 年在中国批准上市后,中国研究评估和监测数据表明,大规模接种RotaTeq后未出现罕见的严重不良事件19,20。另外,中国疑似预防接种异常反应(AEFI)监测数据显示292020年中国共报告226320例AEFI,总报告发生率为40.94/10万剂,其中RotaTeq AEFI报告发生率为14.37/10万剂。
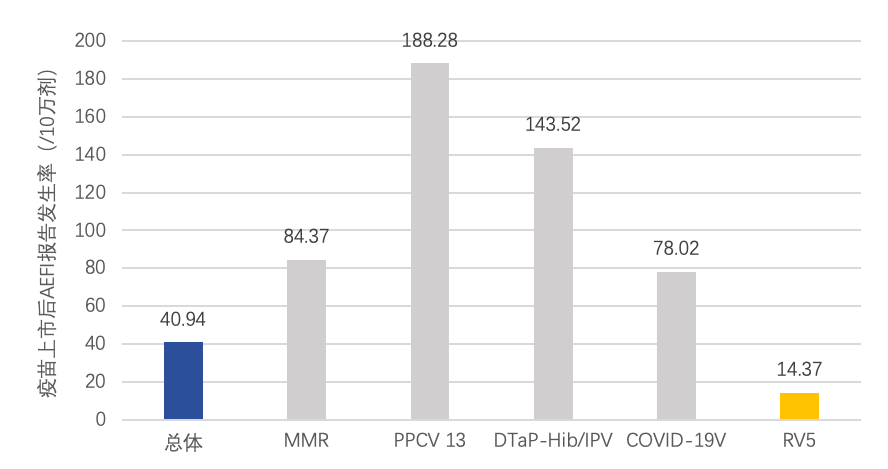
数据来源:张丽娜,李克莉,李燕,等.2020年中国疑似预防接种异常反应监测[J].中国疫苗和免疫,2022,28(02):208-218.DOI:10.19914/j.CJVI.2022041
口服轮状病毒活疫苗
中国兰州生物制品研究所研制的轮状病毒疫苗为LLR株,通用名称与商品名称分别为“口服轮状病毒活疫苗”与“罗特威”。此疫苗于2001年在中国地区上市,但由于暂未被纳入国家免疫规划,适用范围有限。2024年,该疫苗在山西省的采购价格为138元/瓶(3ml)。
自2001年上市以来,LLR已累计使用5,000万剂次以上。临床应用显示,该疫苗对人轮状病毒感染具有一定的保护作用。国内多项研究表明,与对照组相比,接种LLR疫苗组的不良事件发生率较低,未发生肠套叠、死亡等严重不良事件,安全性较好,且腹泻患病率低于对照组21-24。根据现有前瞻队列研究及Meta分析结果来看,LLR对RVGE和严重程度的RVGE的保护效果均为69%至72%之间,与葛兰素史克和默沙东公司生产的轮状病毒疫苗效果相当21,22。基于病例数据和接种记录的回顾性研究发现,接种1剂LLR疫苗对于5岁以下儿童具有一定保护效力,尤其是在重症轮状病毒胃肠炎病例中保护率更高,且研究普遍建议尽早完成全程接种以提高保护效果 39-41。其中一项研究发现北京2015至2017年接种1剂LLR在2-35个月和36-59个月年龄组中,调整后的疫苗有效性(VE)估计值分别为36.2%(95%CI,4.7–57.3%)和-1.6%(95%CI,-224.5–68.2%)42。 广州2002至2004年的研究发现,35月龄以下的儿童中,接种1剂LLR有效性2-11月龄为60.0%,12-23月龄为80.9%,24-35月龄为50% 43。
陕西省的一项研究发现接种轮状病毒疫苗(LLR或RV5, 即RotaTeq)能显著降低5岁以下住院儿童的呕吐天数、呕吐次数的风险44。另有研究利用广东省四个城市的胃肠炎监测数据进行阴性病例对照研究,对比了LLR和RV5在2020-2023年间住院儿童RVGE的保护效果,研究结果显示,和LLR疫苗均能有效预防 RVGE(包括由 G8P[8] 基因型引起的病例)。接种3剂RV5可提供强效保护,而接种2剂 LLR 也是预防轮状病毒感染的有效策略25。
表4.2 LLR, RV5疫苗效力对比(按剂次和严重程度)
| 疫苗种类 | 接种剂次 | 任何程度RVGE疫苗效力(%) | 严重RVGE疫苗效力(%) |
| RV5 | 1 | 51.7 | 67.2 |
| 2 | 37.6 | 74.0 | |
| 3 | 64.1 | 86.6 | |
| LLR | 1 | 38.7 | 57.7 |
| 2 | 74.6 | 73.4 | |
| 3 | 58.8 | -27.8 |
口服三价重配轮状病毒减毒活疫苗(Vero细胞)
LLR3为中国兰州生物制品研究所开发生产的基于LLR的人-羊重配三价RV疫苗,包含G2、G3和G4血清型。一项随机双盲、安慰剂对照多中心研究14表明,在中国婴幼儿中,LLR3对任何程度的RVGE、严重RVGE以及任何血清型引起的住院病例具有较好的免疫原性和保护效力。LLR3对其他RV血清型也表现出交叉保护作用,尤其是对G9血清型引起的严重RVGE的保护效力达到70.3%(95% CI: 59.9%-77.9%)。临床试验研究表明,在2至35月龄的健康儿童中接种LLR3具有良好的安全性,不良反应发生率为21.43%。常见的不良反应包括发热、呕吐和腹泻,其发生率与其他口服轮状病毒疫苗相似,未见全身严重不良反应。此疫苗已于2023年在国内上市23。2025年,LLR3在新疆自治区的挂网采购价格为218元/瓶 (2ml)。
研发过程中的轮状病毒疫苗
RV3-BB疫苗
在研发中的口服轮状病毒疫苗中,印度尼西亚PTBioFarma公司在研的口服轮状病毒疫苗RV3-BB是候选疫苗之一。这是一种基于RVG3P自然减毒新生儿株的口服疫苗,目前正处于临床试验阶段3,24。一期临床试验表明,RV3轮状病毒疫苗(BioFarma)在所有参与者队列(成人、儿童和新生儿)中均具有良好的耐受性。新生儿接种3剂次该疫苗显示出良好的免疫原性25。
口服六价重配轮状病毒减毒活疫苗(HRV6)
我国武汉生物制品研究所研发的 HRV6含有 G1、G2、G3、G4、G8 和 G9 六种血清型,涵盖了 A 群 轮状病毒99. 6%的 G 血清型病毒5。HRV6的早期临床试验显示在成人和婴幼儿中具有良好的耐受性,在婴儿中使用具有良好的免疫原26。一项随机、双盲、安慰剂对照的多中心III期临床试验在河北省、湖南省、浙江省和广西壮族自治区开展。研究结果显示,HRV6组与安慰剂组的不良事件和严重不良事件发生率无显著差异27。
我国在研轮状病毒疫苗概况
表4.3 我国在研轮状病毒疫苗概况
| 疫苗名称 | 生产厂商 | 覆盖型别 | 注册分类 | 研发进度 |
| III价轮状病毒基因重配疫苗 | 兰州生物制品研究所 | G2、G3、G4 | 1 | 申报生产* |
| 口服六价重配轮状病毒活疫苗(Vero细胞) | 武汉生物制品研究所 | G1、G2、G3、G4、G8 、G9 | 1 | III期临床已完成,已申请上市 |
| 重组三价轮状病毒亚单位疫苗 | 迈科康生物 | P[4]、P[6]、p[8] | 1.2 | II期临床 |
| 单价轮状病毒灭活疫苗 | 昆明生物制品研究所 | G1P[8] | – | II期临床 |
| 口服六价人-牛重配株RV减毒活疫苗(Vero细胞) | 科兴生物 | G1、G2、G3、G4、G9、P1A[8] | 1 | I期临床 |
| 口服五价重配轮状病毒减活疫苗(Vero细胞) | 康泰生物 | G1、G2、G3、G4、G9 | 3.2 | I期临床 |
| 轮状病毒灭活疫苗(Vero细胞) | 中国医学科学院生物学研究所 | G1、G2、G3、G4、G9 | 1 | I期临床 |
| 轮状病毒灭活疫苗 | 智飞生物 | G1P[8] | 1 | I期临床 |
| 冻干四价口服轮状病毒活疫苗(FRhL-2细胞) | 博沃生物 | – | 1 | 获批临床 |
| Wa-VP4* 候选轮状病毒疫苗 | 厦门万泰 | — | — | 临床前 |
| 轮状病毒 mRNA-LNP 疫苗 | 中国医学科学院生物学研究所 | — | — | 临床前 |
*2023年4月已获批在国内上市
国际上在研轮状病毒疫苗概况
表4.4 国际上在研轮状病毒疫苗概况
| 疫苗名称 | 生产商/开发者 | 疫苗特征 | 覆盖型别 | 研发进度 |
| RV3-BB | PT BioFarma, 印尼万隆 | 基于人类新生儿活减毒菌株;新生儿(“出生剂量”)和婴儿免疫程序正在评估中 | G3P[6] | 第2/3期;第2b期已完成 |
| VP8亚单位蛋白疫苗 | PATH轮状病毒疫苗计划,美国 | 基于重组蛋白的亚单位疫苗;注射给药途径正在评估中 | 三价截短VP8:P[4],P[6],P[8] | 第3期 |
| 四价UK-BRV | Shanta Biotechnics | 基于活减毒牛-人重组菌株 | G1-4 | 第3期,研发中止 |
| 五价UK-BRV | Instituto Butantan, 巴西 | 基于活减毒牛-人重组菌株 | G1-4、G9 | 第1期 |
| 六价UK-BRV* | 武汉生物制品研究所,中国 | 基于活减毒牛-人重组菌株 | G1-4、G8、G9 | 第2/3期 |
| 灭活G1P[8]疫苗 | CDC, 美国 | 热灭活人株;注射给药途径正在评估中 | G1P[8] | 临床前;动物研究 |
| VP6-诺如病毒VLP | 坦佩雷大学 | 基于病毒样颗粒的亚单位疫苗;注射给药途径正在评估中 | 不适用;VP6蛋白 | 临床前;动物研究 |
| 表达V6蛋白 | 辛辛那提儿童医院医疗中心 | 基于重组蛋白的亚单位疫苗;注射给药途径正在评估中 | 不适用;VP6蛋白 | 临床前;动物研究 |
| VLP VP2/6(/7) | 贝勒医学院 | 基于病毒样颗粒的亚单位疫苗;注射给药途径正在评估中 | 不适用;VP2/6/7蛋白 | 临床前;动物研究 |
*为我国产品
有研究推测,下一代注射型轮状病毒疫苗可能具有更高的保护效力,或者也可以通过与口服轮状病毒疫苗联合接种提高效果。此外,该研究还强调下一代注射型轮状病毒疫苗与百白破疫苗联合接种可有效改善轮状病毒疫苗的接种覆盖率,并且此联合接种方案被认为是具有成本效益的选择。研究支持了注射型轮状病毒疫苗研发的必要性45。
参考文献
- Vaccine in National Immunization Programme Update. https://cdn.who.int/media/docs/default-source/immunization/hpv/vaccineintrostatus.pdf
- Burnett, E., Parashar, U. D. & Tate, J. E. Real-world Effectiveness of Pentavalent Rotavirus Vaccine in Shanghai of rotavirus vaccines, 2006–19: a literature review and meta-analysis. The Lancet Global Health 8, e1195–e1202 (2020).
- Cárcamo-Calvo, R., Muñoz, C., Buesa, J., Rodríguez-Díaz, J. & Gozalbo-Rovira, R. The Rotavirus Vaccine Landscape, an Update. Pathogens 10, 520 (2021).
- Clark, A. et al. Efficacy of live oral rotavirus vaccines by duration of follow-up: a meta-regression of randomised controlled trials. The Lancet Infectious Diseases 19, 717–727 (2019).
- 轮状病毒胃肠炎专家共识编写组. 儿童轮状病毒胃肠炎免疫预防专家共识(2024年版). 中华预防医学杂志,2024,58(00):1-33. DOI:10.3760/cma.j.cn112150-20231220-00472
- 国家药品监督管理局数据查询. https://www.nmpa.gov.cn/datasearch/search-info.html?nmpa=aWQ9YjFjOWVlMTQyOGJhMzkyZTFmMTdiN2ZkYjk0M2M1ZjQmaXRlbUlkPWZmODA4MDgxODNjYWQ3NTAwMTg0MDg4MWY4NDgxNzlm.
- VIEW-hub. (n.d.). Rotavirus vaccine. Retrieved October 11, 2024, from https://view-hub.org/vaccine/rota
- https://www.cdc.gov/vaccines/vpd/rotavirus/hcp/index.html
- https://www.path.org/our-impact/media-center/india-made-rotavirus-vaccine-achieves-world-health-organization-prequalification/
- https://www.path.org/our-impact/media-center/global-rotavirus-vaccine-options-expand-world-health-organization-prequalification-new-vaccine-india/
- 口服三价重配轮状病毒减毒活疫苗(Vero细胞)说明书https://www.vacmic.com/htm/20246/13_2861.htm
- Giaquinto, C. et al. Summary of effectiveness and impact of rotavirus vaccination with the oral pentavalent rotavirus vaccine: A systematic review of the experience in industrialized countries. Human Vaccines 7, 734–748 (2011).
- Lawrence, J. et al. Safety and immunogenicity of pentavalent rotavirus vaccine in a randomized, double-blind, placebo-controlled study in healthy elderly subjects. Human Vaccines & Immunotherapeutics 10, 2247–2254 (2014).
- Xia, S. et al. Efficacy, immunogenicity and safety of a trivalent live human-lamb reassortant rotavirus vaccine (LLR3) in healthy Chinese infants: A randomized, double-blind, placebo-controlled trial. Vaccine 38, 7393–7400 (2020).
- 魏宇航 et al. RotaTeq疫苗在全球高死亡率地区对儿童轮状病毒胃肠炎保护效果和安全性的Meta分析. 中华实验和临床病毒学杂志 37, 106–111 (2023).
- Desselberger, U. Differences of Rotavirus Vaccine Effectiveness by Country: Likely Causes and Contributing Factors. Pathogens 6, 65 (2017).
- Dadonaite, B., Ritchie, H. & Roser, M. Rotavirus vaccine – an effective tool that prevents children dying from diarrhea. Our World in Data (2024).
- Mo, Z. et al. Immunogenicity of pentavalent rotavirus vaccine in Chinese infants. Vaccine 37, 1836–1843 (2019).
- 黄伟彬, 郭伟芳, 孙颖舜, & 朱颖青. 广州市从化区婴幼儿接种五价重配轮状病毒减毒活疫苗的安全性调查. 中国农村卫生 12, 75–77 (2020).
- 方挺, 赵薛飞, 韩航涛, 倪红霞, & 张良. 宁波市6-12周龄婴儿五价人-牛重配轮状病毒减毒活疫苗预防接种后不良事件主动监测. 中国疫苗和免疫 27, 580–583 (2021).
- 黎明强, 吕榜军, & 沈潘燕. 口服轮状病毒活疫苗罗特威保护效果及安全性Meta分析. 中华疾病控制杂志 19, 1038–1041, 1056 (2015).
- 曹兵, 王雄虎, 游志毅, 谈书勤, & 胡贵方. 我国轮状病毒疫苗保护效果的Meta分析. 中华疾病控制杂志, 17(3), 203-207 (2013). https://doi.org/10.3760/cma.j.issn.1673-4092.2013.03.003
- Xia S, Du J, Su J, et al. Efficacy, immunogenicity and safety of a trivalent live human-lamb reassortant rotavirus vaccine (LLR3) in healthy Chinese infants: A randomized, double-blind, placebo-controlled trial. Vaccine. 2020;38(46):7393-7400. doi:10.1016/j.vaccine.2020.04.038
- Glass, R. I., Tate, J. E., Jiang, B. & Parashar, U. The Rotavirus Vaccine Story: From Discovery to the Eventual Control of Rotavirus Disease. J Infect Dis 224, S331–S342 (2021).
- Yi, Y., Liu, J., Zhang, Y. et al. Effectiveness of Lanzhou Lamb Rotavirus Vaccine and RotaTeq Against Hospitalized Rotavirus Infections Among Children During 2020-2023 in Guangdong Province, China: A Test-Negative Case-Control Study. Infect Dis Ther 13, 2301–2317 (2024). https://doi.org/10.1007/s40121-024-01040-y
- At Thobari, J. et al. Safety and immunogenicity of human neonatal RV3 rotavirus vaccine (Bio Farma) in adults, children, and neonates in Indonesia: Phase I Trial. Vaccine 39, 4651–4658 (2021).
- Safety and immunogenicity of a novel oral hexavalent rotavirus vaccine a phase I clinical trial.pdf.
- Wu, Z. et al. Efficacy, safety and immunogenicity of hexavalent rotavirus vaccine in Chinese infants. Virologica Sinica 37, 724–730 (2022).
- Cates, J., Tate, J. E. & Parashar, U. Rotavirus vaccines: progress and new developments. Expert Opin Biol Ther 22, 423–432 (2022).
- 张丽娜,李克莉,李燕,等.2020年中国疑似预防接种异常反应监测[J].中国疫苗和免疫,2022,28(02):208-218.DOI:10.19914/j.CJVI.2022041.
- Bencina G, Costantino C, Mameli C, Sabale U, Murtagh J, Newman R, Ahern A, Bhaila R, Sanchez AO, Martinon-Torres F, Carias C. Real-world impact of rotavirus vaccination in European healthcare settings: a systematic literature review. Expert Rev Vaccines. 2022 Aug;21(8):1121-1136. doi: 10.1080/14760584.2022.2075851. Epub 2022 Jun 16. PMID: 35708263.
- Sun ZW, Fu Y, Lu HL, Yang RX, Goyal H, Jiang Y, Xu HG. Association of Rotavirus Vaccines With Reduction in Rotavirus Gastroenteritis in Children Younger Than 5 Years: A Systematic Review and Meta-analysis of Randomized Clinical Trials and Observational Studies. JAMA Pediatr. 2021 Jul 1;175(7):e210347. doi: 10.1001/jamapediatrics.2021.0347. Epub 2021 Jul 6. PMID: 33970192; PMCID: PMC8111566.
- Gidengil C, Goetz MB, Newberry S, Maglione M, Hall O, Larkin J, Motala A, Hempel S. Safety of vaccines used for routine immunization in the United States: An updated systematic review and meta-analysis. Vaccine. 2021 Jun 23;39(28):3696-3716. doi: 10.1016/j.vaccine.2021.03.079. Epub 2021 May 25. PMID: 34049735.
- Pereira P, Benninghoff B, Moerman L. Systematic literature review on the safety and immunogenicity of rotavirus vaccines when co-administered with meningococcal vaccines. Hum Vaccin Immunother. 2020 Nov 1;16(11):2861-2872. doi: 10.1080/21645515.2020.1739485. Epub 2020 Apr 16. PMID: 32298219; PMCID: PMC7746238.
- Raboba JL, Rahajamanana VL, Rakotojoelimaria HE, Masembe YV, Martin PR, Weldegebriel GG, Diallo AO, Burnett E, Tate JE, Parashar UD, Mwenda JM. Monovalent rotavirus vaccine effectiveness and long-term impact among children< 5 years old in Antananarivo, Madagascar, 2010–2022. Vaccine. 2024 Dec 2;42(26):126321.
- Ma W, Wei Z, Guo J, et al. Effectiveness of Pentavalent Rotavirus Vaccine in Shanghai, China: A Test-Negative Design Study. J Pediatr. 2023;259:113461. doi:10.1016/j.jpeds.2023.113461
- Tian, Y., Shen, L., Li, W., Yan, H., Fu, J., Liu, B., Wang, Y., Jia, L., Li, G., Suo, L., Zhang, D., Gao, Z., & Wang, Q. (2024). Major changes in prevalence and genotypes of rotavirus diarrhea in Beijing, China after RV5 rotavirus vaccine introduction. Journal of medical virology, 96(5), e29650. https://doi.org/10.1002/jmv.29650
- Xiao, Guoguang MD*,§; Zhu, Tingting MD†; Wang, Zhiling MD*,‡; Xie, Xiaoping MD∥; Shu, Min MD*,§; Gao, Shan MD*; Wang, Liyuan MD*; Zhou, Wei MD†; Deng, Jianjun MD*,††; Xie, Yongmei MD*,‡; Yu, Fan MD†,‡. Pentavalent Rotavirus Vaccine Coverage and Trends in Rotavirus Detection Before and After This Vaccination in Chengdu, China. The Pediatric Infectious Disease Journal 43(11):p e397-e399, November 2024. | DOI: 10.1097/INF.0000000000004441
- Li J, Zhang Y, Yang Y, Liang Z, Tian Y, Liu B, Gao Z, Jia L, Chen L, Wang Q. Effectiveness of Lanzhou lamb rotavirus vaccine in preventing gastroenteritis among children younger than 5 years of age. Vaccine. 2019 Jun 12;37(27):3611-6.
- Fu C, Wang M, Liang J, He T, Wang D, Xu J. Effectiveness of Lanzhou lamb rotavirus vaccine against rotavirus gastroenteritis requiring hospitalization: a matched case-control study. Vaccine. 2007 Dec 17;25(52):8756-61.
- Fu C, He Q, Xu J, Xie H, Ding P, Hu W, Dong Z, Liu X, Wang M. Effectiveness of the Lanzhou lamb rotavirus vaccine against gastroenteritis among children. Vaccine. 2012 Dec 17;31(1):154-8.
- Li J, Zhang Y, Yang Y, Liang Z, Tian Y, Liu B, Gao Z, Jia L, Chen L, Wang Q. Effectiveness of Lanzhou lamb rotavirus vaccine in preventing gastroenteritis among children younger than 5 years of age. Vaccine. 2019 Jun 12;37(27):3611-6.
- Fu C, Wang M, Liang J, He T, Wang D, Xu J. Effectiveness of Lanzhou lamb rotavirus vaccine against rotavirus gastroenteritis requiring hospitalization: a matched case-control study. Vaccine. 2007 Dec 17;25(52):8756-61.
- 朱妮,张义,陈飒,冯瑄,李华,胡伟军,张超,曹磊,张少白. 轮状病毒疫苗对<5岁腹泻住院儿童轮状病毒感染和临床症状保护效果研究. [J] 中国疫苗和免疫, 2024,v.30(04):447-450
- Hausdorff WP, Price J, Debellut F, Mooney J, Torkelson AA, Giorgadze K, Pecenka C. Does anybody want an injectable rotavirus vaccine, and why? Understanding the public health value proposition of next-generation rotavirus vaccines. Vaccines. 2022 Jan 20;10(2):149.
- Li J, Zhang Y, Yang Y, et al. Effectiveness of Lanzhou lamb rotavirus vaccine in preventing gastroenteritis among children younger than 5 years of age. Vaccine. 2019;37(27):3611-3616. doi:10.1016/j.vaccine.2019.03.069





