全球轮状病毒疾病负担
发病率
几乎每名儿童5岁前至少发生一次轮状病毒感染1。轮状病毒感染导致的胃肠炎(Rotavirus gastroenteritis, RVGE)是全球性的由轮状病毒感染引起的常见传染病,在5岁以下儿童中高发2。RVGE通常急性起病,主要症状包括恶心、呕吐和腹泻,可能伴有发热。2016年全球轮状病毒感染导致的RVGE发病估计2.58亿例2。由轮状病毒引起的腹泻发病率为80‰(95%CI:67.1‰-94.1‰),5岁以下儿童为408.6‰(95%CI:311.6‰-533.1‰)3。
死亡率
2016年,腹泻是所有年龄段的第八大死亡原因3。世界卫生组织(WHO)2024年公布的数据显示,腹泻是导致5岁以下儿童死亡的第三大死亡原因,每年造成全球约443,832名儿童死亡7。全球范围内,腹泻大多由被污染的水源和食物造成,社会经济发展水平较低的国家往往具有较高的死亡率。
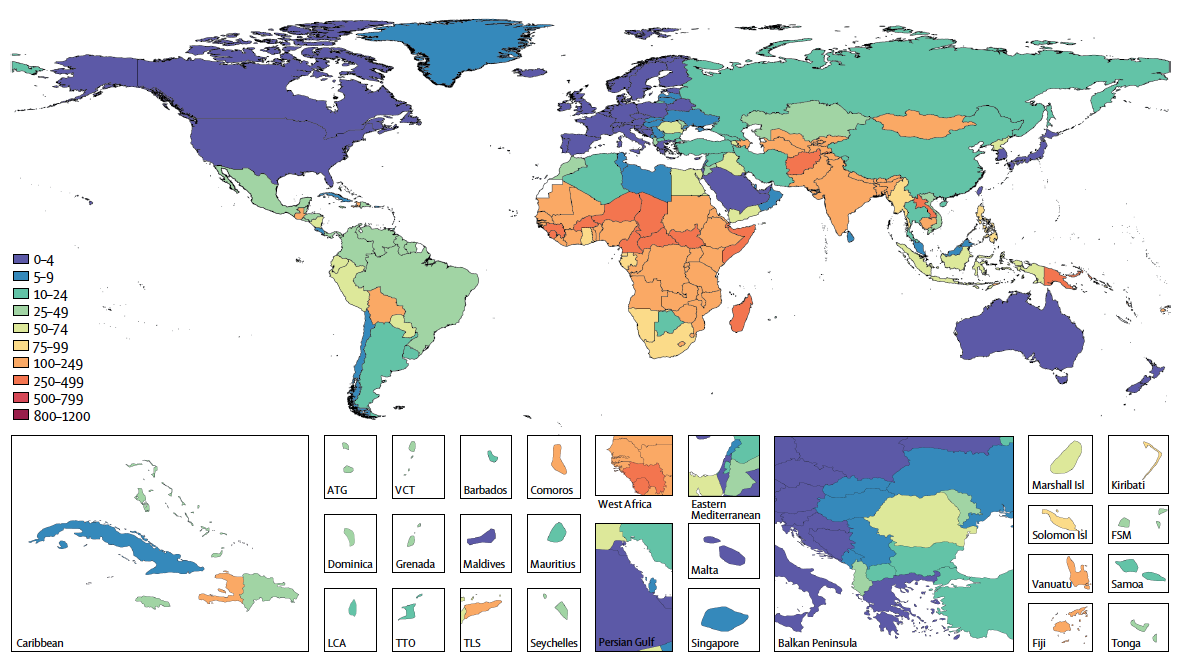
U5MR=under-5 mortality rate. ATG=Antigua and Barbuda. VCT=Saint Vincent and the Grenadines. LCA=Saint Lucia. TTO=Trinidad and Tobago. Isl=Islands. FSM=Federated States of Micronesia. TLS=Timor-Leste. 图片来源:https://doi.org/10.1016/S1473-3099(18)30362-1
轮状病毒感染是导致腹泻死亡的主要原因,全球范围内5岁以下儿童中死亡率最高,但在中高发展水平地区70岁以上老年人的死亡率更高3,8。基于全球疾病负担研究(Global Burden of Disease, GBD)2019年数据的研究显示,全球范围轮状病毒感染导致的死亡占腹泻死亡总数的19.11%;尽管较1990年的26.95%有所下降,但仍居于该研究纳入的13种引起腹泻病原体致死率的首位8。2019年,轮状病毒引起的全人口死亡率估计为3/10万,而5岁以下人口中死亡率估计为22.9/10万;轮状病毒感染估计导致全球约15.2万5岁以下儿童死亡,占轮状病毒导致的所有死亡病例的64.68%9。此外,70岁以上的老年人群也是轮状病毒感染死亡风险较高的年龄组。研究发现,中高发展水平国家70岁以上人口的轮状病毒感染死亡率1990年至2019年期间呈上升趋势。同时,2019年中高发展水平国家70岁以上人口的轮状病毒感染死亡率高于其5岁以下儿童死亡率,这可能与中高发展水平的国家人口迅速老龄化,老年人免疫力下降并伴有基础疾病从而增加传染病的死亡风险有关8,10。
1990年以来,全球大部分国家由轮状病毒引起的死亡率成下降趋势,但地区间不平等现象依然存在。随着全球范围内轮状病毒疫苗的推广使用,卫生环境、水环境的改善,由轮状病毒感染引起的死亡病例由1990年的659,053例降低至2019年的235,331例8。但社会经济发展水平较低的地区,尤其撒哈拉以南的非洲、南亚以及东南亚国家由轮状病毒感染引起的死亡率仍较高(见图3.2),与卫生标准低、营养不良、医疗卫生服务不足等因素有关8。
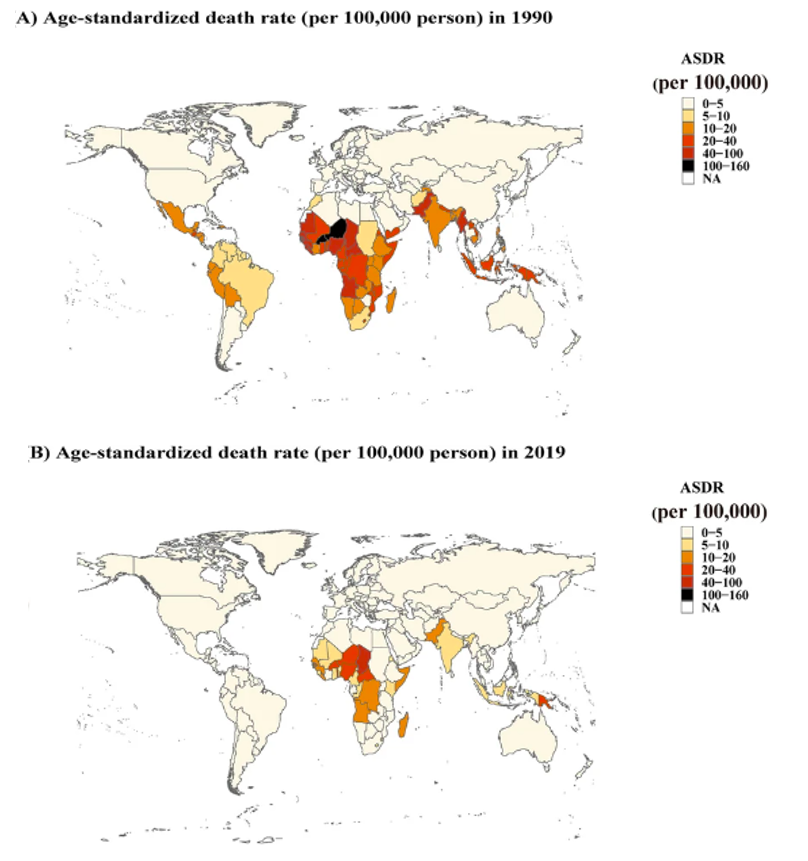
图片来源:https://doi.org/10.1186/s12985-022-01898-9
2013 年WHO提出了“肺炎和腹泻综合全球行动计划”,该计划的目标之一是至 2025 年全球可预防的重度腹泻比 2010 年降低 75%,将5岁以下儿童因腹泻导致的死亡率降至每1000例活产1例以下11。然而,根据2019年仅轮状病毒引起的腹泻死亡率的估算,我们需要进一步努力才能实现这一目标。
门诊和住院负担
在医疗服务利用方面,轮状病毒感染发病会导致严重的门诊及住院负担,也是造成儿童腹泻住院的主要原因。针对亚洲国家的系统发现,2000至2011年5岁以下儿童轮状病毒相关门诊就诊的发病率为每年每千名儿童5.6至45.3例;住院率为每千名儿童2.1至20.0例4。一项系统综述研究估计,2019年全球因轮状病毒导致的住院病例约为176万例(四分位数间距(IQR):1,422,645-2,925,372);并且儿童轮状病毒住院率在死亡率较低的国家中最高,这可能由不同群体在获取医疗服务和寻求医疗服务方面的差异导致5。就轮状病毒感染引发的腹泻而言,在未将轮状病毒疫苗列入免疫规划的国家,5岁以下儿童腹泻住院病例中大约有40%是由轮状病毒引起的(如图3.3)6。另有一项系统综述发现,5岁以下未接种轮状病毒疫苗的儿童轮状病毒腹泻的住院比例为0.612。
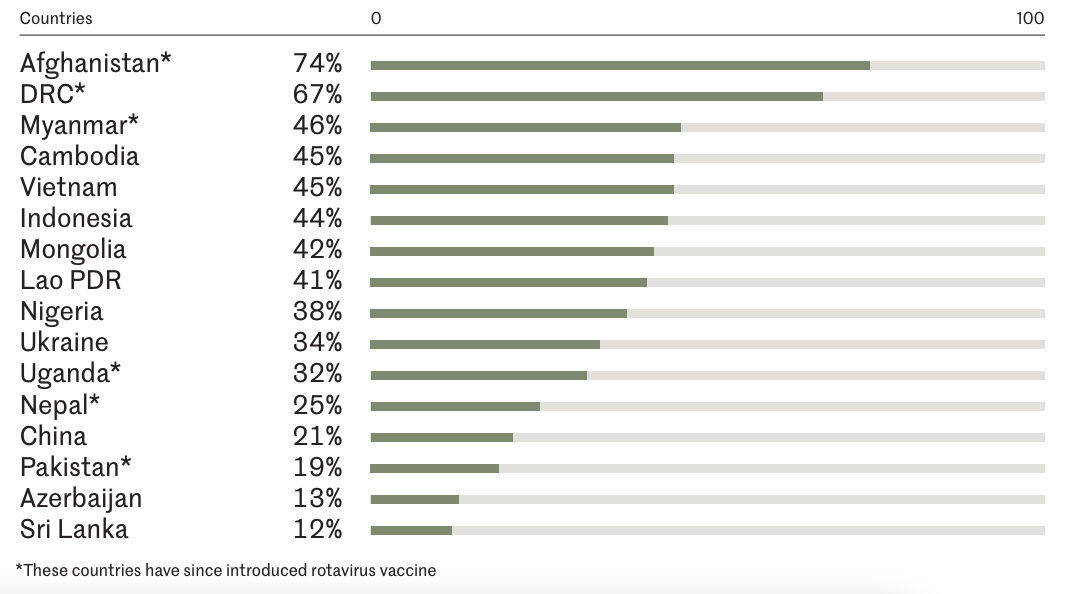
图片来源:Rotavirus Organization of Technical Allies6
社会心理负担
轮状病毒感染还会造成社会心理负担,影响患儿及其照护者的生活质量。轮状病毒感染儿童的父母会经历明显的心理压力,产生更明显的焦虑、担心等情绪,同时对家庭的整体生活质量产生负面影响13–15。轮状病毒感染造成的腹泻、住院会同时降低患儿及其照护者的生活质量,且有研究发现轮状病毒感染的腹泻患儿生活质量低于非RV感染的腹泻患儿16,17。
全球轮状病毒造成的经济负担
由RVGE造成的医疗服务利用给全球范围带来沉重的经济负担。亚洲国家由RVGE造成的直接医疗费用平均每例20至2142美元(折算为2009年的美元价值)18。一项针对73个由全球疫苗免疫联盟(Global Alliance for Vaccines and Immunization,Gavi)支持或满足支持资质国家的研究估计,由RVGE造成的门诊总费用(包括直接医疗费用、非医疗费用、间接费用)平均每例为16.81美元(折算为2015年的美元价值),住院平均每例90.68美元19。另一项针对63个不符合Gavi资助条件的中等收入国家的研究估计,由RVGE造成的门诊病例,在社会层面上平均每例的费用为23.2美元(折算为2018年的美元价值);而住院治疗的病例,平均每例的费用为352美元20。
中国轮状病毒疾病负担
发病率
轮状病毒感染是造成我国腹泻的主要原因,发病主要集中在5岁以下儿童。2014-2015年我国病毒性腹泻占所有腹泻病例的90%以上,其中由轮状病毒感染导致的腹泻2014年占95.7%,2015年为93.1%18。2009-2020 年,国家科技重大专项传染病监测技术平台信息管理系统中全国 28 个省份的252 家哨点医院共对 114,606 例门诊腹泻病例开展轮状病毒检测,发现轮状病毒阳性病例21,872例,其中84.3%为5岁以下病例22。有荟萃研究发现,2011年至2018年间,5岁以下因腹泻就诊的患儿中有34.0% (95% CI: 31.3%-36.8%)被诊断为轮状病毒阳性;其中轮状病毒导致的住院占39.7% ( 95% CI: 34.2%-45.6%),高于门诊(23.9%; 95% CI: 18.1%-30.9%)23。
全国范围内报告的5岁以下儿童轮状病毒腹泻发病率呈波动上升趋势。轮状病毒被列入我国丙类传染病中的“其他感染性腹泻”进行管理和报告,根据我国传染病报告信息管理系统,2005年至2018年全国共报告5岁以下儿童轮状病毒腹泻约820,588例,年均报告发病率为63.7/10万,报告发病率从2005年的8.4/10万波动上升至2018年的178.1/10万(报告省份由17个增加到30个)24。
轮状病毒引起的5岁以下儿童腹泻病发病具有年龄和性别分布特征,6月龄至2岁婴幼儿轮状病毒感染率最高,且男性高于女性。0至12月龄的报告发病例数整体随月龄增长呈上升趋势,12月龄之后成下降趋势。<5月龄的儿童占13.1%(107,845例),6月龄至2岁占70.3%(576,874例),报告发病数高峰为11~13月龄儿童(163,947例)。性别分布男性高于女性,且具有统计学差异24。另有荟萃研究发现因腹泻就诊的5岁以下儿童RV阳性率集中在6-23月龄,其中12-23月龄组的轮状病毒阳性率最高为40.1%,其次为6-11月龄33.1%23。而两岁以下腹泻患儿中每年约有22%患中重度腹泻,从而大幅增加儿童发育不良和死亡的风险25。
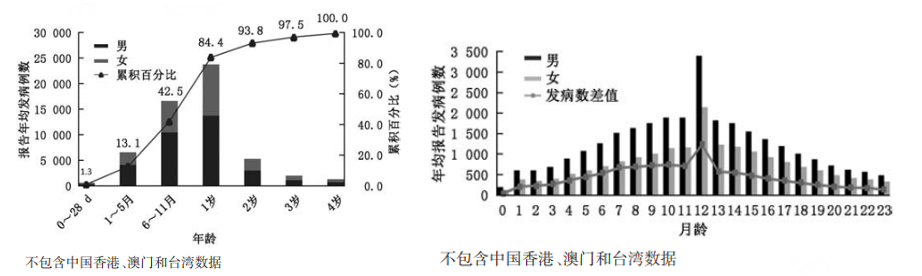
骆洪梅, 冉陆, 孟玲, 连怡遥 & 王丽萍. 2005—2018年中国5岁以下轮状病毒腹泻报告病例流行特征分析. 中华预防医学杂志 181-182-183-184-185–186 (2020)
死亡率
目前腹泻性疾病造成我国5岁以下儿童死亡的病例较少,但轮状病毒感染仍是导致腹泻死亡的主要原因。随着社会经济的发展、医疗及公共卫生系统的完善,我国儿童死亡率整体呈下降趋势。2016年全国5岁以下儿童死亡率为10.2‰,同年5岁以下儿童腹泻死亡1,342例(95% CI: 1102-1659),每十万人口死亡率2.2例(95% CI: 1.8-2.7)3,26。根据2021年全国死因监测系统报告公布的数据显示,5岁以下由腹泻性疾病导致的死亡人数仅20人,约占全死因的0.3%27。然而,轮状病毒感染一直是造成腹泻性疾病死亡的主要原因。2003年至2012年,中国5岁以下儿童腹泻导致的死亡总数估计为127,539例,其中有53,559例(占42%)是由轮状病毒引起28。2017年至2021年间全国病毒性腹泻突发公共卫生事件共2171起,其中轮状病毒引起的15起,共导致3人死亡,占所有病毒感染性腹泻死亡病例的75%(共4例死亡)29。
2000年以来我国由轮状病毒导致的死亡率整体呈下降趋势。2002年,轮状病毒导致我国约1.34万名5岁以下儿童死亡30。从2003年到2012年,我国5岁以下儿童因轮状病毒腹泻死亡的人数下降了73.5% (从每年1.05万人下降到2791例);5岁以下儿童中,轮状病毒腹泻的死亡率从每千名活产婴儿0.66例下降到0.17例,下降幅度达74.2%28。医疗卫生服务能力的改善、疫苗的接种、清洁水源的供应和卫生厕所的使用等因素均可能促进了腹泻死亡率的下降。
我国由轮状病毒导致的死亡率存在城乡和东中西差异。研究发现,约有93%的轮状病毒腹泻引起的死亡发生在农村地区。2012年,农村地区轮状病毒腹泻的死亡率(每千名活产婴儿0.33例)为城市地区的11倍(每千名活产婴儿0.03例)28。尽管轮状病毒感染病例在南方地区更为常见,但整体死亡率呈现东中西差异,中西部省份的死亡率相对较高(见图3.5)。尽管我国目前腹泻和轮状病毒导致的死亡率很低,这项研究结果提示我们仍需关注轮状病毒在不同经济发展水平地区间引发的疾病严重程度差异。
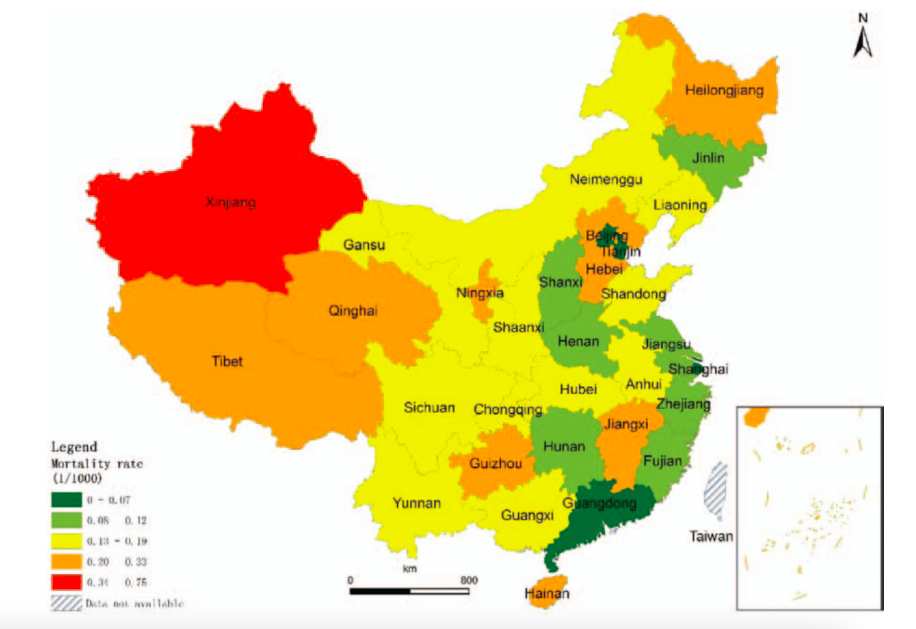
图片来源:Zhang J, Duan Z, Payne DC, et. al. Rotavirus-specific and overall diarrhea mortality in Chinese children younger than 5 years: 2003 to 2012. The Pediatric infectious disease journal. 2015 Oct 1;34(10):e233-7. DOI: 10.1097/INF.0000000000000799
门诊和住院负担
轮状病毒感染是造成我国腹泻门诊、住院的重要因素,同时带来沉重的门诊和住院负担。2009-2020年,全国28个省份的252家医院门诊腹泻病例中轮状病毒感染的占19%22。轮状病毒也是导致中国儿童腹泻住院的主要病因,我国一项基于27家医院的回顾性研究显示,在2016-2020年共28,189例病毒性胃肠炎住院患儿中,轮状病毒阳性患儿占比达到89.7%,显著高于其他病毒31。由轮状病毒感染引起的住院负担集中在3岁以下儿童(图3.6)。
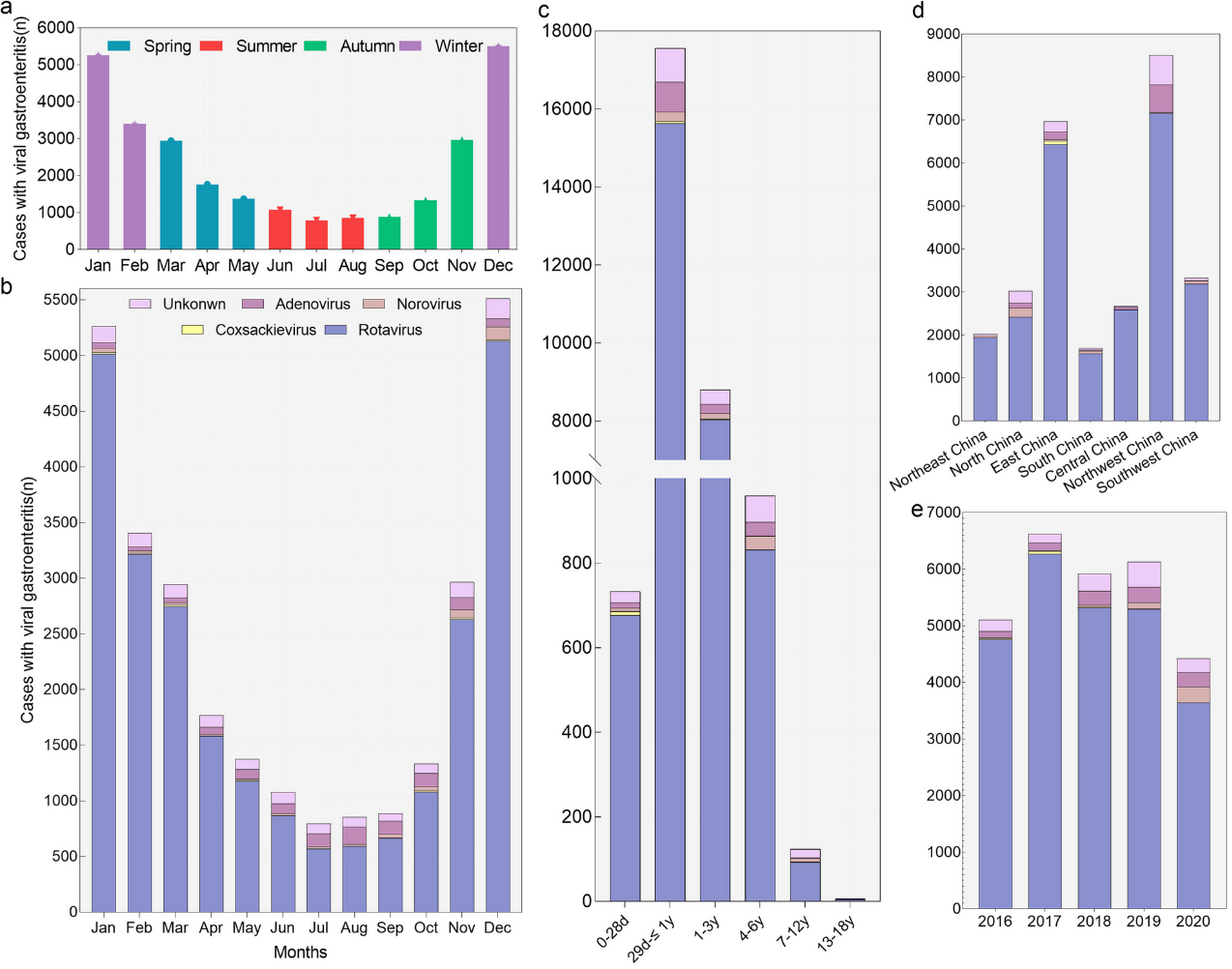
图a显示了不同季节住院治疗的病毒性胃肠炎患儿数量。图b显示了不同月份的病原体分布情况。季节划分是基于月份的:冬季为1月至3月,春季为4月至6月,夏季为7月至9月,秋季为10月至12月。图c-e则展示了不同年龄组、年份和中国不同地区的病原体分布。”unkonwn”的定义是指病毒性胃肠炎患儿的病因未明确为特定病毒引起。
图片来源:Li F, Guo L, Li Q, Xu H, Fu Y, Huang L, Feng G, Liu G, Chen X, Xie Z. Changes in the epidemiology and clinical characteristics of viral gastroenteritis among hospitalized children in the Mainland of China: a retrospective study from 2016 to 2020. BMC pediatrics. 2024 May 4;24(1):303. https://doi.org/10.1186/s12887-024-04776-1
中国于1998年开始建设5岁以下腹泻住院儿童轮状病毒哨点监测,2021年我国RV哨点监测网络已覆盖31个省(自治区、直辖市)的42家哨点医院2。基于全国监测网络的研究发现,2011年至2019年间共采集到47,386例因腹泻住院的5岁以下患儿,其中轮状病毒检测阳性病例共14,952例(31.55%)32。2019年全国20省监测医院采集的5,038例5岁以下儿童腹泻住院病例中1,247例为轮状病毒阳性(24.75%);其中河南省哨点的轮状病毒阳性检出率最高(182/338,53.85%)33。研究还发现了住院患儿中轮状病毒阳性检出率的城乡差异:农村阳性率(28.53%)高于城市(22.71%);季节差异:冬季最高(42.43%),夏季最低(9.76%)32。
基于杭州数据的研究显示,2007-2008年5岁以下儿童轮状病毒相关门诊发生率约为每千人20.1例,住院为每千人2.1例;2岁以下儿童轮状病毒相关门诊和住院发生率更高,分别为每千人39.1例,每千人4.1例34。2007年我国由轮状病毒感染引起的5岁以下儿童门诊2007年估计为348万例,2013年估计为116万例;住院2007年估计为22万例,2013年估计为11万例2,35。
社会心理负担
目前我国针对轮状病毒感染造成社会心理负担的研究尚不充分,需要研究进一步探索。
中国轮状病毒造成的经济负担
中国承担着严重的轮状病毒感染经济负担,是亚洲RVGE造成的经济负担最沉重的国家36。一项基于山东、河南、甘肃三家医院的研究,调查了2020年至2021年间因轮状病毒引起腹泻而就诊的5岁以下患者的直接医疗费用。据该研究测算,轮状病毒引起的门诊患者和住院患者的人均费用分别为389.85元和4131.10元37。
一项Meta分析报告,按照2022年人均GDP折算,我国5岁以下儿童因轮状病毒胃肠炎造成的例均社会总成本约2025元(包括直接医疗成本、非医疗成本和间接成本),假设直接医疗成本可报销50%则次均私人支出约1482元(表3.1)38。
表3.1 5岁以下儿童轮状病毒急性胃肠炎门诊、住院相关成本汇总
| 成本 (人民币) | 门诊 | 住院 | 合计 |
| n = 3328 例 | n = 2757 例 | n = 6085 例 | |
| 直接成本(均值,95%置信区间) | 278 (236–320) | 2784 (2268–3299) | 1391 (1038–1745) |
| 直接医疗成本(均值,95%置信区间) | 180 (154–208) | 2220 (1888–2552) | 1087 (806–1369) |
| 直接非医疗成本(均值,95%置信区间) | 121 (88–154) | 644 (447–841) | 365 (257–472) |
| 间接成本(均值,95%置信区间 | 275 (225–325) | 846 (910–1643) | 713 (527–900) |
| 社会总成本(均值,95%置信区间) | 526 (45–618) | 3900 (3064–4737) | 2025 (1532–2518) |
| 私人总成本(均值,95%置信区间) | 47 (349–521) | 2790 (2101–3480) | 1482 (1114–1849) |
参考文献
- WHO. Rotavirus vaccines: WHO position paper. July 2021. Wkly Epidemiol Rec, 2021, 96(28):301-320. https://www.who.int/publications/i/item/WHO-WER9628
- 轮状病毒胃肠炎专家共识编写组. 儿童轮状病毒胃肠炎免疫预防专家共识(2024年版). 中华预防医学杂志,2024,58(00):1-33. DOI:10.3760/cma.j.cn112150-20231220-00472
- Troeger C, Blacker BF, Khalil IA, Rao PC, Cao S, Zimsen SR, Albertson SB, Stanaway JD, Deshpande A, Abebe Z, Alvis-Guzman N. Estimates of the global, regional, and national morbidity, mortality, and aetiologies of diarrhoea in 195 countries: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet Infectious Diseases. 2018 Nov 1;18(11):1211-28. DOI:https://doi.org/10.1016/S1473-3099(18)30362-1
- Kawai K, O’Brien MA, Goveia MG, Mast TC, El Khoury AC. Burden of rotavirus gastroenteritis and distribution of rotavirus strains in Asia: a systematic review. Vaccine. 2012 Feb 8;30(7):1244-54.
- Benjamin D Hallowell, Tyler Chavers, Umesh Parashar, Jacqueline E Tate, Global Estimates of Rotavirus Hospitalizations Among Children Below 5 Years in 2019 and Current and Projected Impacts of Rotavirus Vaccination, Journal of the Pediatric Infectious Diseases Society, Volume 11, Issue 4, April 2022, Pages 149–158, DOI:https://doi.org/10.1093/jpids/piab114
- Rotavirus Organization of Technical Allies. The epidemiology and disease burden of rotavirus. https://publichealth.jhu.edu/sites/default/files/2024-02/rota-brief3-burden2022ax.pdf
- World Health Organization. (2024, March 7). Diarrhoeal disease. World Health Organization. Retrieved October 11, 2024, from https://www.who.int/news-room/fact-sheets/detail/diarrhoeal-disease
- Du Y, Chen C, Zhang X, Yan D, Jiang D, Liu X, Yang M, Ding C, Lan L, Hecht R, Zhu C. Global burden and trends of rotavirus infection-associated deaths from 1990 to 2019: an observational trend study. Virology journal. 2022 Oct 20;19(1):166. DOI:https://doi.org/10.1186/s12985-022-01898-9
- Vos T, Lim SS, Abbafati C, Abbas KM, Abbasi M, Abbasifard M, Abbasi-Kangevari M, Abbastabar H, Abd-Allah F, Abdelalim A, Abdollahi M. Global burden of 369 diseases and injuries in 204 countries and territories, 1990–2019: a systematic analysis for the Global Burden of Disease Study 2019. The lancet. 2020 Oct 17;396(10258):1204-22. DOI:https://doi.org/10.1016/S0140-6736(20)30925-9
- Ciabattini A, Nardini C, Santoro F, Garagnani P, Franceschi C, Medaglini D. Vaccination in the elderly: the challenge of immune changes with aging. Semin Immunol. 2018;40:83–94. https://doi.org/10.1016/j.smim.2018.10.010.
- World Health Organization/The United Nations Children′s Fund (UNICEF) 2013. Ending Preventable Child Deaths from Pneumonia and Diarrhoea by 2025. The integrated Global Action Plan for Pneumonia and Diarrhoea (GAPPD) [Z]. Switzerland: World Health Organization, 2013. https://www.who.int/publications/i/item/9789241505239
- Chavers T, Cates J, Burnett E, Parashar UD, Tate JE. Indirect protection from rotavirus vaccines: a systematic review. Expert Rev Vaccines. 2024 Aug 21. doi: 10.1080/14760584.2024.2395534.
- Aldeán JÁ, Aristegui J, López-Belmonte JL, Pedrós M, Sicilia JG. Economic and psychosocial impact of rotavirus infection in Spain: a literature review. Vaccine. 2014 Jun 24;32(30):3740-51.
- Laizane G, Kivite A, Stars I, Cikovska M, Grope I, Gardovska D. Health-related quality of life of the parents of children hospitalized due to acute rotavirus infection: a cross-sectional study in Latvia. BMC pediatrics. 2018 Dec;18:1-8.
- Carias C, Hu T, Chen YT. Burden of rotavirus gastroenteritis on caregivers: Findings from a systematic literature review. Human Vaccines & Immunotherapeutics. 2022 Nov 30;18(5):2047545. https://doi.org/10.1080/21645515.2022.2047545
- Rochanathimoke O, Riewpaiboon A, Postma MJ, Thinyounyong W, Thavorncharoensap M. Health related quality of life impact from rotavirus diarrhea on children and their family caregivers in Thailand. Expert review of pharmacoeconomics & outcomes research. 2018 Mar 4;18(2):215-22.
- Marlow R, Finn A, Trotter C. Quality of life impacts from rotavirus gastroenteritis on children and their families in the UK. Vaccine. 2015 Sep 22;33(39):5212-6.
- Kawai K, O’Brien MA, Goveia MG, Mast TC, El Khoury AC. Burden of rotavirus gastroenteritis and distribution of rotavirus strains in Asia: a systematic review. Vaccine. 2012 Feb 8;30(7):1244-54.
- Debellut F, Clark A, Pecenka C, Tate J, Baral R, Sanderson C, Parashar U, Kallen L, Atherly D. Re-evaluating the potential impact and cost-effectiveness of rotavirus vaccination in 73 Gavi countries: a modelling study. The Lancet Global Health. 2019 Dec 1;7(12):e1664-74.DOI:https://doi.org/10.1016/S2214-109X(19)30439-5
- Debellut F, Clark A, Pecenka C, Tate J, Baral R, Sanderson C, Parashar U, Atherly D. Evaluating the potential economic and health impact of rotavirus vaccination in 63 middle-income countries not eligible for Gavi funding: a modelling study. The Lancet Global Health. 2021 Jul 1;9(7):e942-56. DOI:https://doi.org/10.1016/S2214-109X(21)00167-4
- 张平, 张静. 我国2014-2015年其他感染性腹泻监测现状分析. 中华流行病学杂志. 2017;38(4): 424-430. DOI:10.3760/cma.j.issn.0254-6450.2017.04.003.
- 唐必成, 孙军玲, 高峰, 王丽萍,郑亚明,李中杰. 2009-2020年我国轮状病毒腹泻流行特征和基因型变化趋势[J]. 中华流行病学杂志, 2024, 45(4): 506-512. DOI: 10.3760/cma.j.cn112338-20231123-00312
- Li J, Wang H, Li D, Zhang Q, Liu N. Infection status and circulating strains of rotaviruses in Chinese children younger than 5-years old from 2011 to 2018: systematic review and meta-analysis. Human Vaccines & Immunotherapeutics. 2021 Jun 3;17(6):1811-7. DOI: https://doi.org/10.1080/21645515.2020.1849519
- 骆洪梅,冉陆,孟玲,连怡遥,王丽萍. 2005—2018年中国5岁以下轮状病毒腹泻报告病例流行特征分析. 中华预防医学杂志,2020,54(02):181-186. DOI:10.3760/cma.j.issn.0253-9624.2020.02.013
- Kotloff KL, Nataro JP, Blackwelder WC, Nasrin D, Farag TH, Panchalingam S, Wu Y, Sow SO, Sur D, Breiman RF, Faruque AS. Burden and aetiology of diarrhoeal disease in infants and young children in developing countries (the Global Enteric Multicenter Study, GEMS): a prospective, case-control study. The lancet. 2013 Jul 20;382(9888):209-22. DOI:https://doi.org/10.1016/S0140-6736(13)60844-2
- 国家统计局 2021年12月,《中国儿童发展纲要(2011—2020年)》终期统计监测报告 https://www.gov.cn/xinwen/2021-12/21/content_5663694.htm
- 中国疾病预防控制中心慢性非传染性疾病预防控制中心,国家卫生健康委统计信息中心. 中国死因监测数据集2021 https://ncncd.chinacdc.cn/xzzq_1/202101/W020230317353700905354.pdf
- Zhang J, Duan Z, Payne DC, Yen C, Pan X, Chang Z, Liu N, Ye J, Ren X, Tate JE, Jiang B. Rotavirus-specific and overall diarrhea mortality in Chinese children younger than 5 years: 2003 to 2012. The Pediatric infectious disease journal. 2015 Oct 1;34(10):e233-7. DOI: 10.1097/INF.0000000000000799
- 任婧寰,王锐.2017—2021年我国其他感染性腹泻突发公共卫生事件流行特征分析.热带病与寄生虫学,2023,21(01):1-6+29.
- Yee EL, Fang ZY, Liu N, Hadler SC, Liang X, Wang H, Zhu X, Jiang B, Parashar U, Widdowson MA, Glass RI. Importance and challenges of accurately counting rotavirus deaths in China, 2002. Vaccine. 2009 Nov 20;27:F46-9. DOI:https://doi.org/10.1016/j.vaccine.2009.08.065
- Li F, Guo L, Li Q, Xu H, Fu Y, Huang L, Feng G, Liu G, Chen X, Xie Z. Changes in the epidemiology and clinical characteristics of viral gastroenteritis among hospitalized children in the Mainland of China: a retrospective study from 2016 to 2020. BMC pediatrics. 2024 May 4;24(1):303. https://doi.org/10.1186/s12887-024-04776-1
- 魏宇航, 李静欣, 彭蕊, 王萌璇, 孙晓曼, 章青, 王宏, 范佳欣, 李丹地, 段招军. 2011-2019年我国G9P[8]型A组轮状病毒腹泻住院患儿流行病学和临床特征分析[J]. 疾病监测, 2022, 37(6): 760-763. DOI: 10.3784/jbjc.202111110589
- 王明雯, 李静欣, 高升辉, 孙晓曼,章青,王宏,李丹地,段招军. 2019年我国5岁以下腹泻住院患儿A组轮状病毒感染的流行特征分析 [J] . 中华实验和临床病毒学杂志, 2022, 36(2) : 172-175. DOI: 10.3760/cma.j.cn112866-20211230-00217.
- Lou JT, Xu XJ, Wu YD, Tao R, Tong MQ. Epidemiology and burden of rotavirus infection among children in Hangzhou, China. Journal of clinical virology. 2011 Jan 1;50(1):84-7.
- Jin H, Wang B, Fang Z, Duan Z, Gao Q, Liu N, Zhang L, Qian Y, Gong S, Zhu Q, Shen X. Hospital-based study of the economic burden associated with rotavirus diarrhea in eastern China. Vaccine. 2011 Oct 13;29(44):7801-6. DOI: https://doi.org/10.1016/j.vaccine.2011.07.104、
- Kawai K, O’Brien MA, Goveia MG, Mast TC, El Khoury AC. Burden of rotavirus gastroenteritis and distribution of rotavirus strains in Asia: a systematic review. Vaccine. 2012 Feb 8;30(7):1244-54. doi:10.1016/j.vaccine.2011.12.092.
- 孟晓庆. 轮状病毒腹泻直接经济负担及其疫苗接种的直接经济效益研究[D]. 山东:山东大学,2023.
- Fu XL, Ma Y, Li Z, Qi YY, Wang SJ, Fu LJ, Wang SM, von Seidlein L, Wang XY. Cost-of-illness of gastroenteritis caused by rotavirus in Chinese children less than 5 years. Human Vaccines & Immunotherapeutics. 2023 Dec 15;19(3):2276619. https://doi.org/10.1080/21645515.2023.2276619





