轮状病毒简介
轮状病毒类型和人群传染源
轮状病毒(Rotavirus, RV)是导致全球5岁以下儿童轮状病毒胃肠炎(rotavirus gastroenteritis, RVGE)的主要原因1,2。轮状病毒分为多个类型,其中A组轮状病毒(RVA)最常见,占所有感染人类RV的95%以上3。该病毒因外层衣壳蛋白的差异而产生多样性型别。在人类,至少有11个不同的G基因型和11个不同的P基因型,两类基因型的不同组合可用于分辨不同的病毒株4-8。全球感染者的主要RV基因型包括G9P[8]、G8P[8]、G3P[8]、G1P[8]、G2P[4]、G4P[8]等4。在人群中,感染了轮状病毒的无症状者和RVGE病人是主要的传染源。一项系统回顾了2005-2023年间全球范围内5岁以下儿童群体轮状病毒基因型的361项数据,发现在引入疫苗后的一到两年内,非疫苗型基因型G2P[4]在疫苗引入地区的流行率显著增加,但在泛美洲地区(AMRO)并没有发现这种差异6。
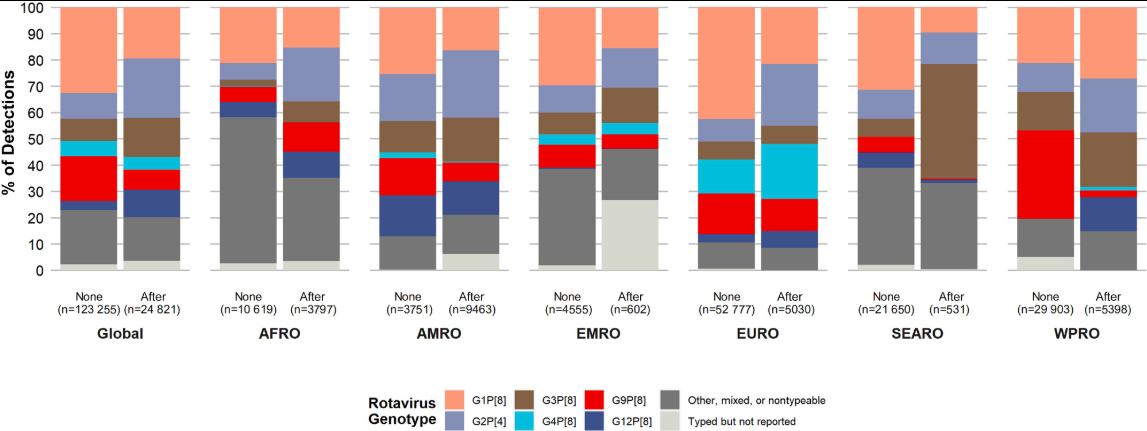
(“None”表示在基因型数据收集时尚未引入轮状病毒疫苗,而“After”表示已引入轮状病毒疫苗。缩写说明:AFRO,非洲地区;AMRO,美洲地区;EMRO,东地中海地区;EURO,欧洲地区;SEARO,东南亚地区;WPRO,西太平洋地区。)
2009年至2014年间,5 岁以下儿童轮状病毒腹泻患者中,A 组轮状病毒是所有毒株中比重最高的血清型, 平均构成比为 95. 1% ( 4404 例) ,B、C 组分 别 只 有 2. 8% ( 129 例) 和 2. 1% ( 98 例) 3。A组轮状病毒在中国流行的主导基因型发生了逐步变化。起初,G基因型以G3和G1为主,后来变为以G9为主导。P基因型则始终以P[8]为主。因此,优势的基因型组合从G3P[8]转变为G9P[8]。这一变化趋势与全球主要流行毒株的变化相一致6。国内的G3、G9和P[8]轮状病毒毒株与俄罗斯和比利时的毒株具有同源性,且这些毒株的发展趋势与俄罗斯的情况相似7,8。在2021-2022年轮状病毒流行季,上海地区观察到:最常见的G型为G8,其次为G9;最常见的P型为P[8],占比97.4%;G8P[8]已成为最常见的流行株26。另有研究发现北京地区的流行的A组轮状病毒基因型也从2019至2021年的G9‐VIP[8]‐III变为2022年的G8‐VP[8]‐III,且G8‐VP[8]‐III株的P[8]序列形成了一个新分支,研究推测此变化可能与轮状病毒疫苗的接种有关 9。
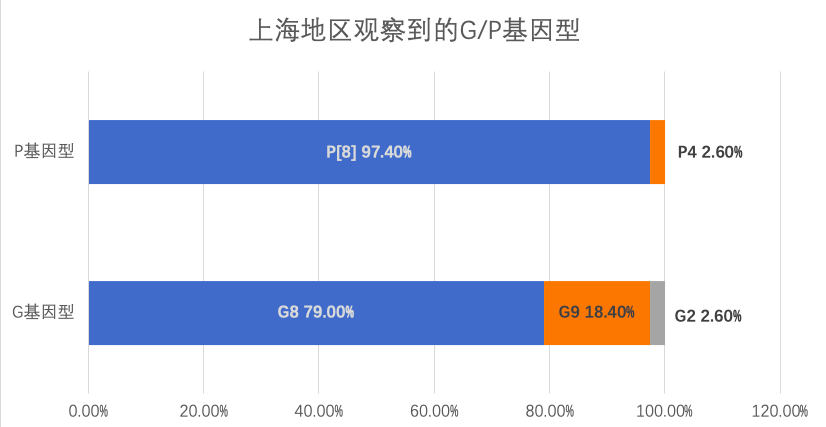
数据来源:Ma W, Wei Z, Guo J, et al. Effectiveness of Pentavalent Rotavirus Vaccine in Shanghai, China: A Test-Negative Design Study. J Pediatr. 2023;259:113461. doi:10.1016/j.jpeds.2023.113461
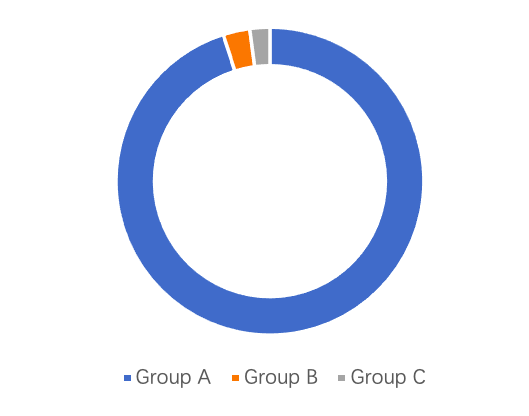
数据来源:儿童轮状病毒胃肠炎免疫预防专家共识(2024年版)
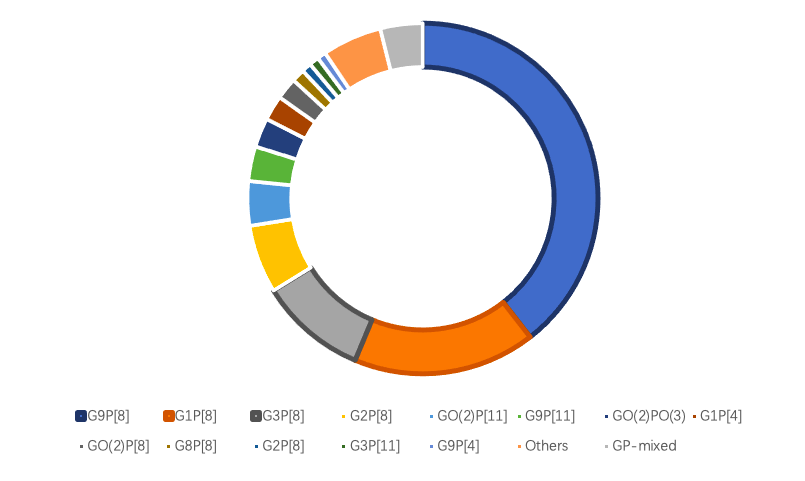
数据来源:儿童轮状病毒胃肠炎免疫预防专家共识(2024年版)
主要传播途径
RVGE 流行必须具备传染源、传播途径和易感人群三个基本环节。若有任一环节缺失,新的 轮状病毒感染就不可能发生。自然和社会等因素会影响三个基本环节和彼此间的相互作用,从而影响疾病的传播和流行3。
轮状病毒主要通过粪-口途径传播,即通过接触受轮状病毒污染的食物、水、物体或表面而感染10。轮状病毒也可能通过呼吸道传播,但这种方式较为少见11。轮状病毒感染通常急性起病,主要症状包括恶心、呕吐、腹泻和发热10,12。严重的轮状病毒感染可能导致水电解质失衡、酸碱平衡紊乱,甚至死亡。
易感人群
5岁以下儿童,尤其是3至35个月大的婴幼儿,是感染轮状病毒的高风险人群,且儿童病例中以非日托儿童的占比最高13,14。虽然成人普遍对轮状病毒有一定的免疫保护,但老年人、免疫力低下的个体和某些特定基因的人群仍容易受到轮状病毒的感染15,16。
流行病学特征
流行季节及地区分布
(1)全球轮状病毒流行季节及地区分布 RVGE 全年均有发生,全球多数地区出现明显季节性高峰,不同地理区域发病高峰存在一定差异3。在轮状病毒疫苗推广之前,RVGE的流行高峰期通常出现在北半球温带地区的秋冬季(10月至次年2月)及早春季(3月至5月)。而在南半球,流行高峰期则主要在5月至10月,也就是该地区的冬季。对于热带地区,RVGE全年都有流行,虽然每个月的流行程度有所波动,但这些波动较小,且不如温带地区的季节性明显17。轮状病毒在非洲、亚洲和南美洲全年有检出,但与此相比,欧洲、北美洲和大洋洲的轮状病毒季节性更为明显。引入轮状病毒疫苗后,这些地区的RVGE流行高峰季节有所推迟,流行周期也相应缩短,并且流行峰值有所降低18,19。轮状病毒疫苗覆盖率对相关疾病的季节性分布有显著影响。例如,在西欧国家大规模推广轮状病毒疫苗接种两年后,流行季节的起始和/或结束时间以及流行高峰期都推迟了4至7周20。
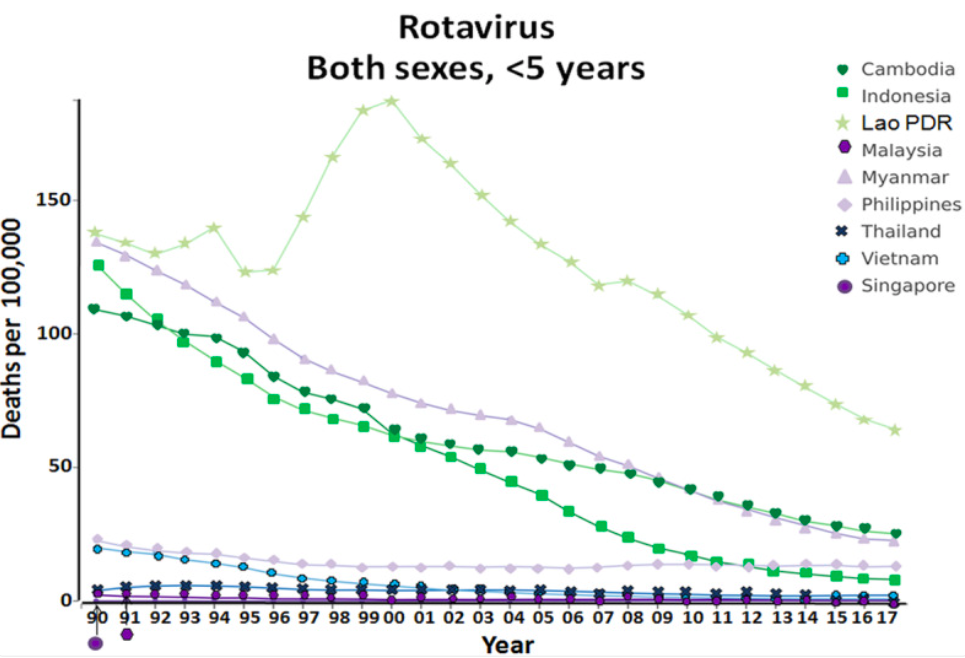
图源来源: Lestari, F. B., Vongpunsawad, S., Wanlapakorn, N. & Poovorawan, Y. Rotavirus infection in children in Southeast Asia 2008–2018: disease burden, genotype distribution, seasonality, and vaccination. J Biomed Sci 27, 66 (2020)
(2)中国轮状病毒流行季节及地区分布
轮状病毒更容易在寒冷季节传播,近年来在中国也出现春季小高峰,是导致5岁以下儿童腹泻的主要原因。RVGE在中国5岁以下儿童中全年都可能发生,并显示出明显的季节性分布3。疾病的发病高峰通常在11月至次年2月,这一时期常被称作“秋季腹泻”。南、北方轮状病毒报告发病率均呈现波动上升趋势,南方报告发病率(90.1/10 万)高于全国水平,北方(26.0/10 万)低于全国水平。南方轮状病毒报告发病数(745 526 例)为北方(74 935 例)的9.9倍,南方的发病趋势与全国发病相似,出现了2013年(160.5 / 10 万)、2017年(211.7 / 10 万)、 2018 年(189.7/10 万)3 个高峰,北方出现 了2017 年 (72.9/10 万)1 个高峰14。
荟萃分析结果表明,2011年至2018年间,中国5岁以下儿童因腹泻就诊的RVGE病例占总体的34.0%,且不同地区的轮状病毒检出率存在明显差异21。根据中国的哨点监测数据,南方省份与北方省份在儿童急性胃肠炎(AGE)住院患儿的轮状病毒阳性率上存在差异。在2016年至2019年期间,南方省份在高峰月(12月或次年1月)的轮状病毒阳性率普遍高于北方省份,而在2020年至2021年期间,北方省份的阳性率则高于南方省份14。此外,南方省份在各年度的低谷期的阳性率也低于北方省份。在中国农村地区,RVGE病例的轮状病毒检出率通常高于城市地区22,23。系统综述显示,中国农村地区和城市地区5岁以下住院患儿的轮状病毒检出率的中位数分别为46.7%和39.8%。
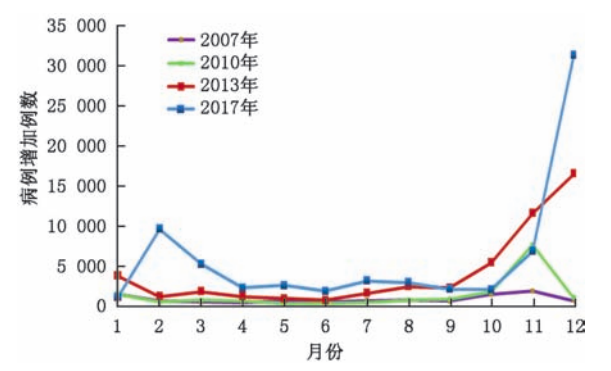
图片来源:骆洪梅, 冉陆, 孟玲, 连怡遥 & 王丽萍. 2005—2018年中国5岁以下轮状病毒腹泻报告病例流行特征分析. 中华预防医学杂志 181-182-183-184-185–186 (2020)
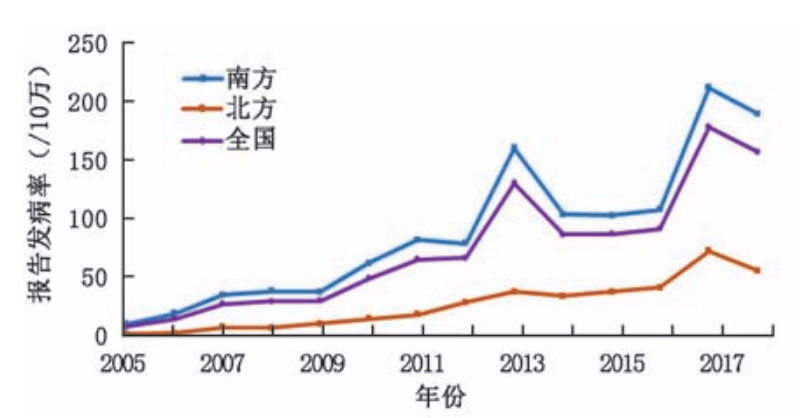
图片来源:骆洪梅, 冉陆, 孟玲, 连怡遥 & 王丽萍. 2005—2018年中国5岁以下轮状病毒腹泻报告病例流行特征分析. 中华预防医学杂志 181-182-183-184-185–186 (2020)
轮状病毒感染的人群分布
轮状病毒感染可在全球各年龄组人群中发生,但以5 岁以下儿童发病为主。男性与女性的发病率差异无统计学意义。国外研究表明,成人在接触因RVGE住院的儿童后,大约50%会产生免疫反应。在轮状病毒疫苗被纳入国家免疫规划(NIP)的地区,大龄儿童、成人和老年人中的急性胃肠炎(AGE)和RVGE的发病率均有所减少15,16,24。在免疫功能低下的患者中,例如先天性免疫缺陷者、骨髓移植或器官移植患者,轮状病毒感染可能引发严重且持续的RVGE,甚至可能威胁生命19。德国、芬兰和澳大利亚的轮状病毒监测数据显示,老年人群中的轮状病毒感染比例呈上升趋势25。
在中国,不同人群的轮状病毒阳性率差异显著,男性(20.2%)高于女性(17.4%)。其中,<5岁婴幼儿的阳性率最高(28.4%),超过成年人的四倍;其次是50-60岁成年人和>60岁老年人,阳性率相对较低,约为6.0%~7.0%。按年度变化趋势来看,2009-2020年间,≥18岁成年人患者的阳性率在低位波动(1.8%)17岁学生组和0~4岁幼儿组腹泻患者的阳性率趋势与总体相似,波动幅度较大,分别从39.2%降至3.3%,从45.4%降至15.5%26。
RVGE在国内的主要患者群体是5岁以下儿童,且这一年龄组内的儿童病例在不同地区和不同时间点显示出明显的差异。在2009年至2020年间,对全国28个省份的252家哨点医院的114,606例腹泻病例进行了轮状病毒检测分析。结果显示,有21,872例检出轮状病毒阳性,其中84.3%为5岁以下儿童病例26。随着年龄的增长,人群中的RVGE发病率呈现下降趋势13。
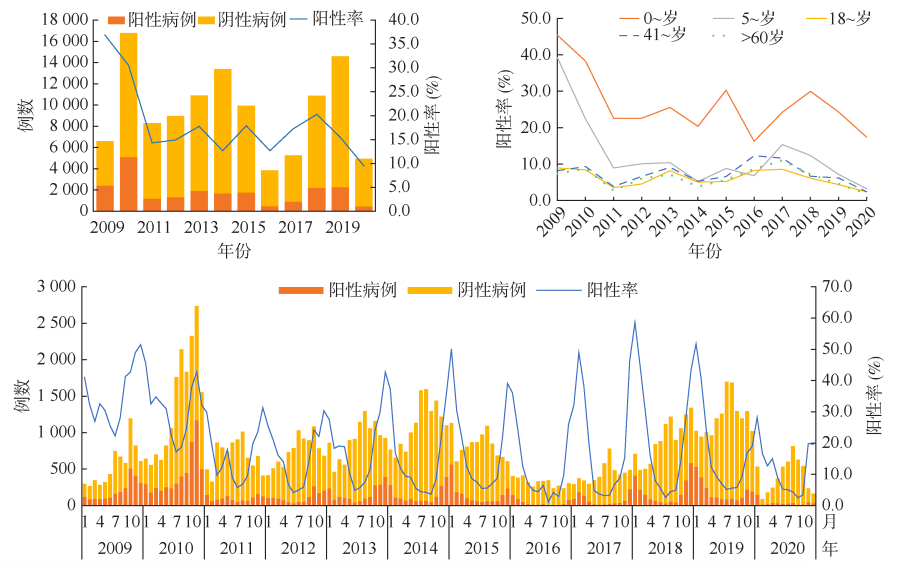
图片来源:唐必成 et al. 2009-2020年我国轮状病毒腹泻流行特征和基因型变化趋势. 中华流行病学杂志 45, 506–512 (2024)
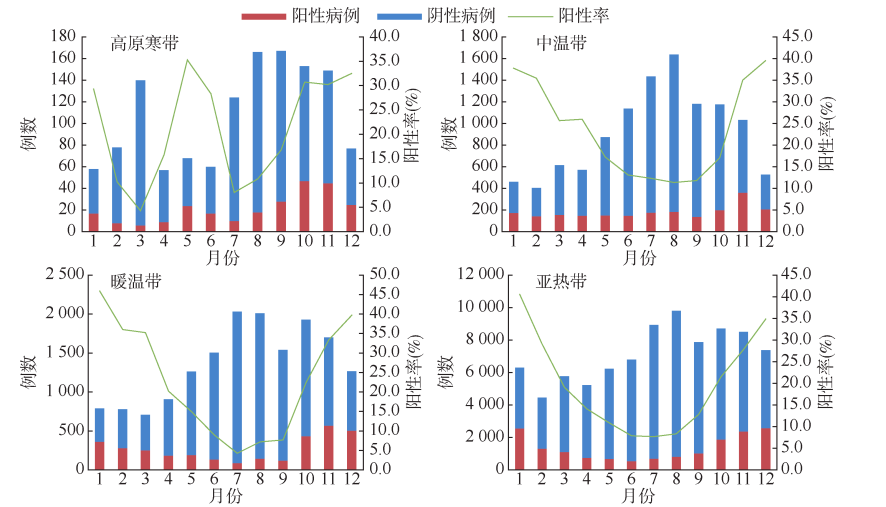
图片来源:唐必成 et al. 2009-2020年我国轮状病毒腹泻流行特征和基因型变化趋势. 中华流行病学杂志 45, 506–512 (2024)
参考文献
- Rotavirus Vaccination | CDC. https://www.cdc.gov/vaccines/vpd/rotavirus/index.html (2023).
- Rotavirus.https://www.who.int/teams/immunization-vaccines-and-biologicals/diseases/rotavirus.
- 儿童轮状病毒胃肠炎免疫预防专家共识(2024年版). 58, (2024).
- Matthijnssens, J. et al. Uniformity of Rotavirus Strain Nomenclature Proposed by the Rotavirus Classification Working Group (RCWG). Arch Virol 156, 1397–1413 (2011).
- Sadiq, A., Bostan, N., Yinda, K. C., Naseem, S. & Sattar, S. Rotavirus: Genetics, pathogenesis and vaccine advances. Reviews in Medical Virology 28, e2003 (2018).
- Avnika B Amin, Jordan E Cates, Zihao Liu, Joanne Wu, Iman Ali, Alexia Rodriguez, Junaid Panjwani, Jacqueline E Tate, Benjamin A Lopman, Umesh D Parashar, Rotavirus Genotypes in the Postvaccine Era: A Systematic Review and Meta-analysis of Global, Regional, and Temporal Trends by Rotavirus Vaccine Introduction, The Journal of Infectious Diseases, Volume 229, Issue 5, 15 May 2024, Pages 1460–1469, https://doi.org/10.1093/infdis/jiad403
- Mao, T. et al. Phylogenetic analysis of the viral proteins VP4/VP7 of circulating human rotavirus strains in China from 2016 to 2019 and comparison of their antigenic epitopes with those of vaccine strains. Front Cell Infect Microbiol 12, 927490 (2022).
- Sashina, T. A., Morozova, O. V., Epifanova, N. V. & Novikova, N. A. Predominance of new G9P[8] rotaviruses closely related to Turkish strains in Nizhny Novgorod (Russia). Arch Virol 162, 2387–2392 (2017).
- Tian, Y., Shen, L., Li, W., Yan, H., Fu, J., Liu, B., Wang, Y., Jia, L., Li, G., Suo, L., Zhang, D., Gao, Z., & Wang, Q. (2024). Major changes in prevalence and genotypes of rotavirus diarrhea in Beijing, China after RV5 rotavirus vaccine introduction. Journal of medical virology, 96(5), e29650. https://doi.org/10.1002/jmv.29650
- Dennehy, P. H. Transmission of rotavirus and other enteric pathogens in the home: The Pediatric Infectious Disease Journal 19, S103–S105 (2000).
- Goldwater, P. N., Chrystie, I. L. & Banatvala, J. E. Rotaviruses and the respiratory tract. Br Med J 2, 1551 (1979).
- Butz, A. M., Fosarelli, P., Dick, J., Cusack, T. & Yolken, R. Prevalence of Rotavirus on High-Risk Fomites in Day-Care Facilities. Pediatrics 92, 202–205 (1993).
- 2015—2021年中山市轮状病毒腹泻的流行特征分析-丁锦颜.pdf.
- 骆洪梅, 冉陆, 孟玲, 连怡遥, 王丽萍. 2005—2018年中国5岁以下轮状病毒腹泻报告病例流行特征分析. 中华预防医学杂志 181-182-183-184-185–186 (2020). DOI:10.3760/cma.j.issn.0253-9624.2020.02.013
- Yandle, Z., Coughlan, S., Dean, J., Hare, D. & De Gascun, C. F. Indirect impact of rotavirus vaccination on viral causes of acute gastroenteritis in the elderly. Journal of Clinical Virology 137, 104780 (2021).
- Rosettie, K. L. et al. Indirect Rotavirus Vaccine Effectiveness for the Prevention of Rotavirus Hospitalization: A Systematic Review and Meta-Analysis. Am J Trop Med Hyg 98, 1197–1201 (2018).
- Troeger, C. et al. Rotavirus Vaccination and the Global Burden of Rotavirus Diarrhea Among Children Younger Than 5 Years. JAMA Pediatr 172, 958 (2018).
- Barsoum, Z. Regional hospitalisation and seasonal variations of Pediatric rotavirus gastroenteritis pre- and post-RV vaccination: a prospective and retrospective study. World J Pediatr 18, 404–416 (2022).
- WHO. Rotavirus vaccines: WHO position paper. July 2021. Wkly Epidemiol Rec, 2021, 96(28):301-320. https://www.who.int/publications/i/item/WHO-WER9628
- Verberk, J. D. M. et al. Impact analysis of rotavirus vaccination in various geographic regions in Western Europe. Vaccine 39, 6671–6681 (2021).
- Li, J., Wang, H., Li, D., Zhang, Q. & Liu, N. Infection status and circulating strains of rotaviruses in Chinese children younger than 5-years old from 2011 to 2018: systematic review and meta-analysis. Hum Vaccin Immunother 17, 1811–1817.
- Chen, C. et al. Prevalence of Enteropathogens in Outpatients with Acute Diarrhea from Urban and Rural Areas, Southeast China, 2010–2014. Am J Trop Med Hyg 101, 310–318 (2019).
- Tian, Y. et al. Group A rotavirus prevalence and genotypes among adult outpatients with diarrhea in Beijing, China, 2011–2018. Journal of Medical Virology 93, 6191–6199 (2021).
- Baker, J. M., Dahl, R. M., Cubilo, J., Parashar, U. D. & Lopman, B. A. Effects of the rotavirus vaccine program across age groups in the United States: analysis of national claims data, 2001–2016. BMC Infect Dis 19, 186 (2019).
- Willame, C. EuroRotaNet: Annual report 2014. https://www.eurorotanet.com/wp-content/uploads/2021/11/EuroRotaNet_report-2020_20211115_Final_v1.0.pdf://www.eurorotanet.com/wp-content/uploads/2021/11/EuroRotaNet_report-2020_20211115_Final_v1.0.pdf
- 唐必成 et al. 2009-2020年我国轮状病毒腹泻流行特征和基因型变化趋势. 中华流行病学杂志 45, 506–512 (2024).
- Ma W, Wei Z, Guo J, et al. Effectiveness of Pentavalent Rotavirus Vaccine in Shanghai, China: A Test-Negative Design Study. J Pediatr. 2023;259:113461. doi:10.1016/j.jpeds.2023.113461





