目前已上市的肺炎球菌疫苗包括肺炎球菌多糖疫苗(Pneumococcal polysaccharide vaccine,PPV)和肺炎球菌多糖结合疫苗(Pneumococcal conjugate vaccine,PCV)。
PPV疫苗
早期4价的肺炎链球菌荚膜多糖疫苗的保护效果已于1945年被证实,1977年美国成功研制出14价肺炎球菌多糖疫苗(PPV14),1978年由美国食品药品管理局(FDA)批准上市。1983年美国率先成功研制出PPV23并广泛使用,覆盖的血清型包括1、2、3、4、5、6B、7F、8、9N、9V、10A、11A、12F、14、15B、17F、18C、19A、19F、20、22F、23F和33F。目前在中国批准上市使用的PPV23有6种,分别由默沙东(中国)有限公司、成都生物制品研究所有限责任公司、玉溪沃森生物技术有限公司、北京民海生物科技有限公司、赛诺菲巴斯德生物制品有限公司和北京智飞绿竹生物制药有限公司生产(表1)。
表1 截至2024年在我国批准上市的PPV232
| 产品名 | 沃朵菲 | 惠益康 | 维民菲乐 | 优博23 | 纽莫法 | 优威克 |
| 类型 | PPV23 | PPV23 | PPV23 | PPV23 | PPV23 | PPV23 |
| 生产商 | 玉溪沃森 | 成都生物制品研究所 | 北京民海生物 | 赛诺菲巴斯德 | 默沙东 | 北京智飞绿竹 |
| 中国上市时间 | 2017年 | 2006年 | 2018年 | 2014年 | 2011年 | 2023年 |
| 中国获批人群 | 2岁以上高危人群 | 2岁以上 | 2岁以上高危人群 | 2岁以上高危人群 | 2岁以上高危人群 | 2 岁以上高危人群 |
| 覆盖血清型 | 1、2、3、4、5、6B、7F、8、9N、9V、10A、11A、12F、14、15B、17F、18C、19A、19F、20、22F、23F和33F | |||||
| 接种剂量 | 1剂次 | |||||
| 接种程序 | 1剂次接种;高危人群再次接种间隔为5年,10岁以下患有肾病综合症、脾切除和镰状细胞病的儿童再次接种间隔为3-5年 | |||||
PCV疫苗
全世界已批准上市的PCV有PCV7、PCV10、PCV13、PCV15、PCV20和PCV21。PCV7于2000年由惠氏(Wyeth)公司(于2009年被辉瑞公司并购)研发成功并经美国批准上市,含4、6B、9V、14、18C、19F和23F血清型,目前已被PCV13替代。PCV10于2009年由葛兰素史克(GlaxoSmithKline)公司研制成功并经欧盟批准上市。PCV13由辉瑞公司(原惠氏公司)于2010年研制成功并经美国批准上市。2021 年 6 月,美国 FDA 批准辉瑞公司的 PCV20 用于 18 岁及以上的成人。获批后,默沙东(MSD) 开发的 PCV15(VAXNEUVANCE™)于 2021 年 7 月在美国上市。2024 年 6 月,美国 FDA 批准了 MSD 开发的另一种成人 PCV – CAPVAXIVE™(PCV21),用于预防成人侵袭性肺炎球菌疾病和肺炎球菌肺炎。
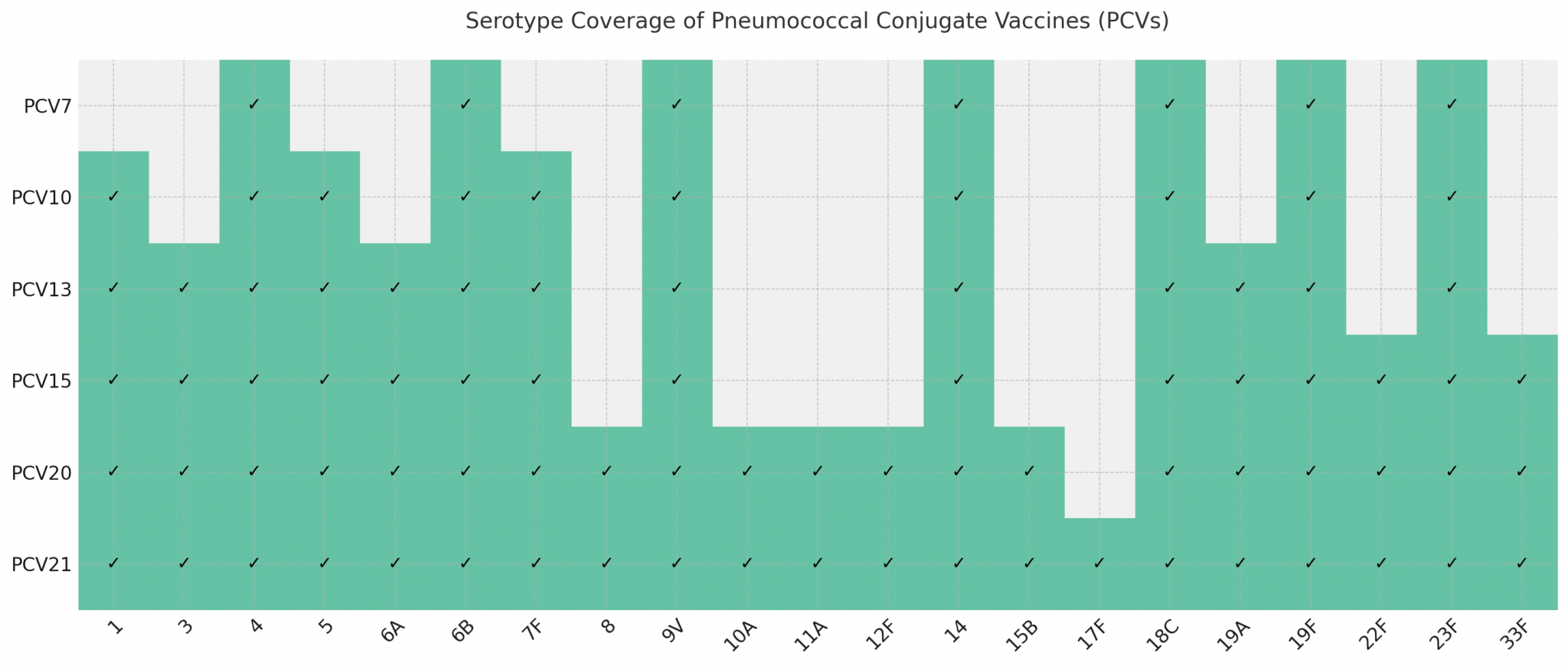
目前中国批准上市使用的PCV13共有四种,分别由辉瑞公司(2016年上市)、玉溪沃森生物技术有限公司(2020年上市)1,北京民海生物科技有限公司(2021年上市)和康希诺生物股份有限公司(2025年上市)4 生产(表2)。
表2 在我国批准上市的PCV疫苗2
| 产品名 | 沛儿13 | 沃安欣 | 维民菲宝 | 优佩欣 |
| 类型 | PCV13 | PCV13 | PCV13 | PCV13i |
| 生产商 | 辉瑞 | 玉溪沃森 | 北京民海 | 康希诺 |
| 全球上市时间 | 2010年 | – | – | – |
| 中国上市时间 | 2016年11月 | 2020年3月 | 2021年10月 | 2025年6月 |
| 中国获批人群 | 6周龄至5岁 | |||
| 覆盖血清型 | 1、3、4、5、6A、6B、7F、9V、14、18C、19A、19F和23F | |||
| 接种程序(6月龄以下婴儿) | 6周龄至6月龄婴儿推荐常规免疫接种程序:共接种4剂。基础免疫在2、4、6月龄各接种一剂,加强免疫在12~15月龄接种一剂。 基础免疫首剂最早可以在6周龄接种,之后各剂间隔1~2个月。 | 1)2-6月龄(最小满6周龄)婴儿:共接种4剂,推荐首剂在2月龄(最小满6周龄)接种,基础免疫接种3剂,每剂次间隔2个月;于12-15月龄时加强接种第4剂; 2)推荐首剂在3月龄接种,基础免疫接种3剂,每剂次接种间隔1个月,于12-15月龄时加强接种第4剂; | 2-6月龄(最小满6周龄)婴儿:共接种4剂,推荐首剂在2月龄(最小满6周龄)接种,基础免疫接种3剂,每剂次间隔2个月;于12-15月龄时加强接种第4剂; | |
| 接种程序(6月龄以上婴儿) | 7至11月龄婴儿: 共接种3剂。首剂与第2剂间隔至少1个月。建议在出生后第二年(满12月龄以后)接种第3剂,与第2剂间隔至少2个月。 12至23月龄幼儿: 共接种2剂,接种间隔至少2个月。 2至5岁儿童(6周岁生日前): 接种1剂。 | |||
PCV通过Spn荚膜多糖与蛋白质共价结合,将荚膜多糖抗原由非T细胞依赖性抗原转变为T细胞依赖抗原,从而能使婴幼儿在免疫后能产生良好的抗体应答,并形成记忆应答。国内外免疫程序多用于婴幼儿,如美国、加拿大使用“3+1”(2、4、6、12月龄)免疫程序,澳大利亚使用“3+0”(2、4、6月龄)免疫程序。随着 PCV 血清型 IPD 的显著减少,英国已将 2020 年(12 周龄和 12 月龄)的 PCV 免疫程序从 “2+1 “改为 “1+1″,作为一种维持性免疫策略3。而PPV为非T细胞依赖性抗原,在2岁以下婴幼儿体内难以诱导有效的保护性抗体,不同个体对不同血清型的应答水平也存在差异。该疫苗在国内外多用于成年人,且接种 PPV23后预防IPD的效力随接种对象年龄的增加而下降,55岁以下人群中效力最高,85岁及以上人群效力最低4。
审核校对:郭磊,李周蓉,张翯昱
参考文献
- 中华预防医学会,中华预防医学会疫苗与免疫分会.肺炎球菌性疾病免疫预防专家共识(2020版).中华预防医学杂志,2020,54(12):1315-1363.DOI: 10.3760/cma.j.cn112150-20201110-01353
- 均来源于企业官网
- Bertran, M., D’Aeth, J. C., Abdullahi, F., et al. (2024). Invasive pneumococcal disease 3 years after introduction of a reduced 1 + 1 infant 13-valent pneumococcal conjugate vaccine immunisation schedule in England: a prospective national observational surveillance study. The Lancet. Infectious diseases, 24(5), 546–556. https://doi.org/10.1016/S1473-3099(23)00706-5
- Shapiro ED, Berg AT, Austrian R, et al. The protective efficacy of polyvalent pneumococcal polysaccharide vaccine. The New England J Medicine, 1991, 325(21):1453-1460. DOI: 10.1056/NEJM199111213252101





