肺炎球菌疾病是全球儿童发病和死亡的主要原因之一。基于过往证据和监测,肺炎球菌一直是全球 5 岁以下儿童的主要感染性死因和抗微生物药物(Antibiotic,以下使用其简化名称“抗生素”)使用的主要原因1。随机对照试验和上市后的观察性研究证实,肺炎球菌结合疫苗(Pneumococcal Conjugate Vaccine, PCV)的大规模接种实施,可减少抗生素的使用,降低疫苗血清型肺炎球菌耐药性。
全球证据
PCV疫苗对抗生素使用的影响
疫苗可减轻抗生素的耐药性负担,部分原因是疫苗可预防通常需要使用抗生素治疗的感染。急性呼吸道感染(ARI)和腹泻是低收入国家儿童使用抗生素的主要原因。在这些国家,可用于指导ARI和腹泻治疗的诊断工具很少,因此临床上采用抗生素治疗上述疾病,主要是通过疑似病例判断而非基于确切的诊断病因来处理2。
一项研究估算了低收入国家24-59 月龄儿童中与ARI相关的抗生素使用发生率。每 100 名 24-59 月龄的儿童每年的ARI发病率从 89.5例次 到 194.8 例次不等,抗生素治疗的估计比例从 30.0% 到 69.4% 不等。该研究也通过纳入18个中低收入国家儿童的数据进行病例对照分析,发现与未接种疫苗的儿童相比,接种至少三剂PCV10/13的儿童发生使用抗生素治疗的ARI几率降低了8.7%2。
基于2018年PCV疫苗的全球覆盖水平(66.8%),研究估计 PCV10/13 免疫接种的直接效果是每年可在低收入国家/地区 24-59 个月大的儿童中预防 2380 万 (95% CI: 4.2-52.0 百万) 例使用抗生素治疗的ARI; 如果 PCV10/13 的覆盖范围扩大到低收入国家/地区所有 24-59 个月龄的儿童,那么疫苗接种的直接效果可额外再预防 2170 万次(95% CI: 3.8-47.5百万)使用抗生素治疗的ARI3。
在肺炎链球菌引起的儿童急性中耳炎(AOM)方面,一项系统回顾指出,在PCV纳入国家免疫规划后(尤其是PCV13),抗生素耐药的肺炎球菌株大幅减少,尽管血清型替代仍具挑战,抗生素耐药性和 AOM 的总体负担却有所下降,凸显了 PCV 对公共卫生的积极影响。PCV 疫苗可有效降低儿童 AOM 的发病率和耐药肺炎球菌株的流行率,减少对广谱抗生素的需求,并在抗生素管理方面发挥了重要作用4。
PCV疫苗接种实施前后肺炎球菌耐药性
在引入PCV疫苗之前,关于肺炎球菌携带和侵袭性肺炎球菌疾病(IPD)的监测研究表明,相较于非疫苗血清型,PCV疫苗血清型更易携带对常用抗生素敏感性降低或具有耐药性的谱系。南非开展的一项上市前随机对照试验及美国两项上市后病例对照研究均表明:接种PCV疫苗的儿童相较于未接种者,发生抗生素耐药性肺炎球菌引起的IPD风险显著降低5。多项主要在高收入国家开展的肺炎球菌携带及侵袭性肺炎球菌疾病(IPD)多年监测研究表明:对青霉素和大环内酯类药物敏感性降低或具有耐药性的非疫苗血清型肺炎球菌比例呈上升趋势6,7,8。
一项2021年的系统综述和meta回归分析描述了儿童鼻咽部定植和 IPD 肺炎球菌分离物的易感性随时间推移而发生的变化。研究发现,在实施 PCV 后,对青霉素、磺胺甲噁唑-三甲氧苄青霉素和第三代头孢菌素的非敏感性和耐药性有所降低;对四环素的耐药性的流行率有所下降。该研究没有发现肺炎球菌分离株对大环内酯类药物不敏感的流行率在PCV引入前后发生变化的证据3。
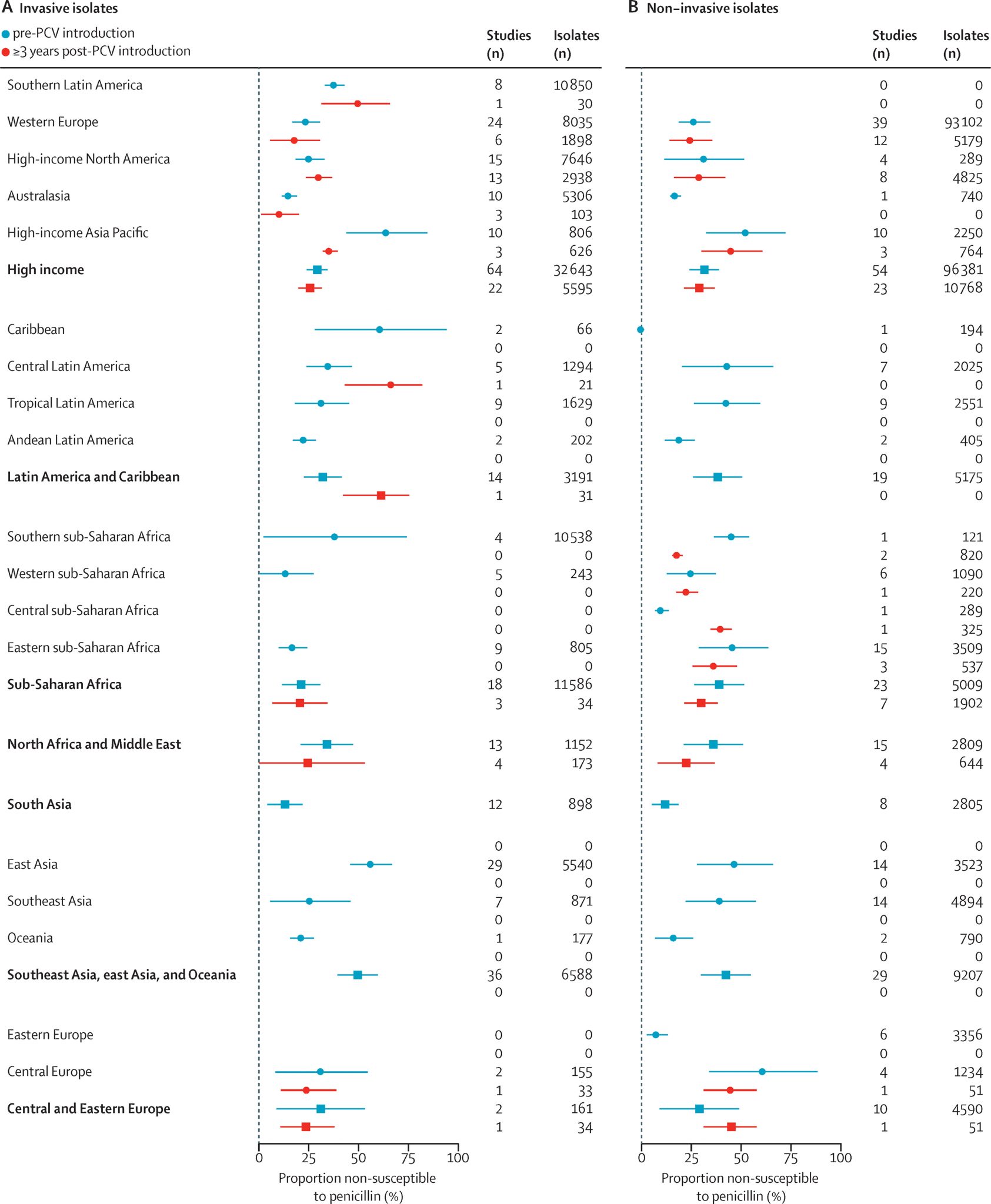
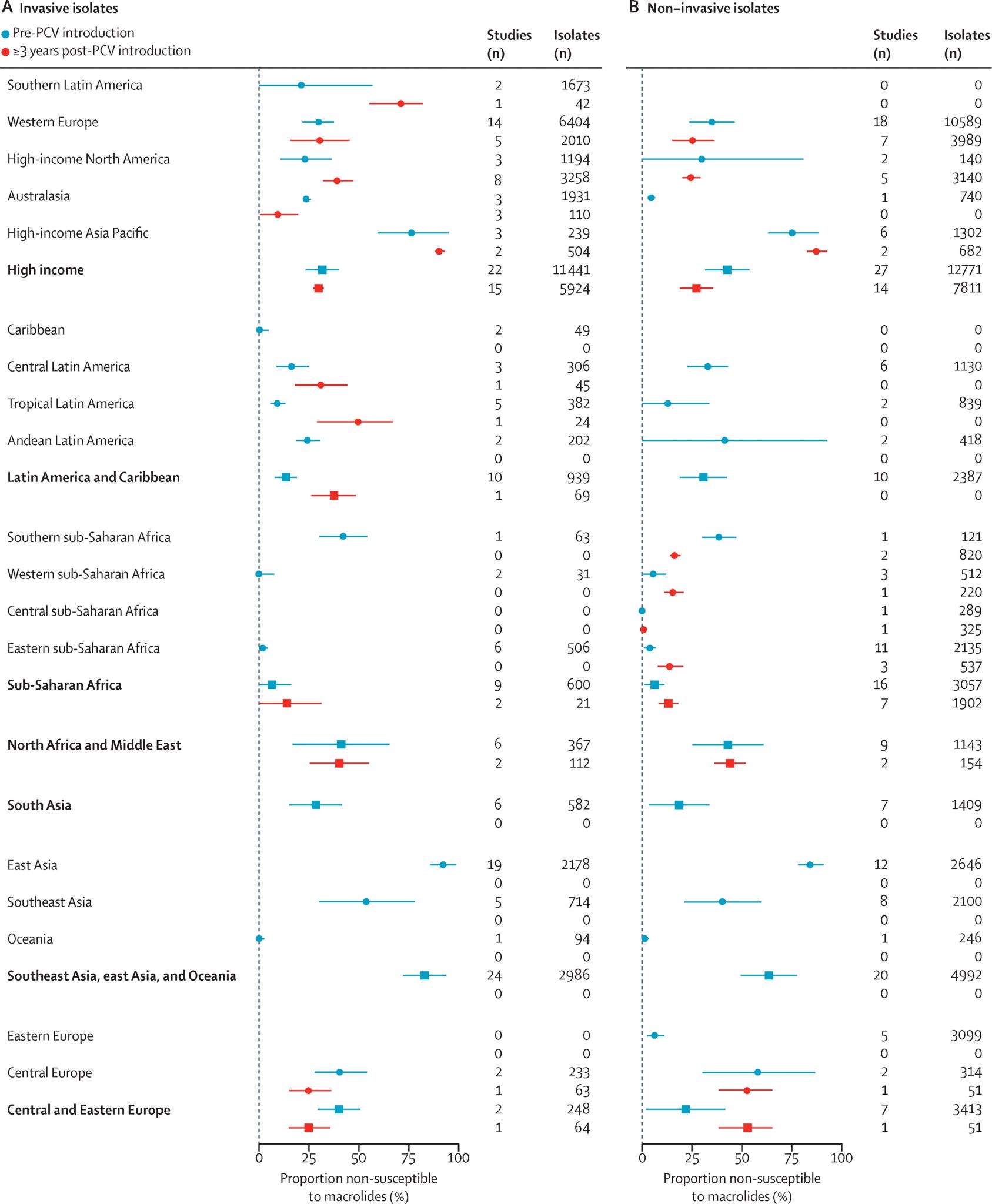
该综述的研究团队评估显示,在PCV疫苗刚引入时,疫苗血清型中对青霉素耐药的菌株绝对流行率比非疫苗血清型高7.6%(95%CI: 4.5-10.8),对大环内酯类药物耐药的菌株绝对流行率比非疫苗血清型高11.5%(95%CI: 6.7-16.4)。尽管研究者发现疫苗血清型和非疫苗血清型中对青霉素耐药的菌株流行率均有下降,但疫苗血清型的下降幅度更为显著3。此外,针对大环内酯类药物,PCV疫苗引入后,无论是疫苗血清型还是非疫苗血清型,对大环内酯类药物耐药的菌株流行率均未呈现显著变化3。
中国情况
在总体肺炎链球菌耐药性方面,我国儿科的肺炎链球菌耐药性日益严峻,对常用抗生素的交叉耐药和多重耐药发生率高9。2024年一项北京某儿童医院的研究显示,2015年到2022年,分离自非脑膜炎患儿的肺炎链球菌对青霉素的耐药率由2015年的6.5%逐渐降至2022年的0.6%,对头孢噻肟、头孢吡肟和美罗培南的耐药率呈下降趋势,但对四环素、克林霉素和红霉素的耐药率较高10。另外一项研究分析了2012-2020年广州地区的肺炎链球菌耐药情况,发现多重耐药肺炎链球菌呈逐年递增趋势,美罗培南和头孢噻肟出现耐药率上升趋势,青霉素的耐药减少11。
我国在PCV疫苗接种与肺炎链球菌耐药性方面的研究较为有限。PCV7 于 2008 年在中国上市;2016 年 ,PCV13取代了 PCV7引入市场。作为非国家免疫规划疫苗,PCV13的接种需要家庭自费,其覆盖率长期维持在低水平。一项系统综述回顾了2017年至2024年期间发表的关于中国大陆14岁以下儿童中分离出的肺炎双球菌血清型的研究,发现肺炎球菌血清型分布及其抗生素耐药性情况在PCV13作为自费疫苗引入后保持相对稳定。抗菌药耐药性最明显的是红霉素,为 93.73%(95%CI:90.58-96.88%),其次是阿奇霉素、四环素、克林霉素和磺胺甲噁唑。血清型流行率和疫苗覆盖率因地区和菌株类型而异12。
一项在中国海南开展的研究,评估了不同PCV13 覆盖率的地区,5岁以下儿童肺炎链球菌鼻咽部携带株携带及其对常用抗生素耐药性的影响。研究于2022年在海南省的海口市(高覆盖率地区)、万宁、白沙和琼中(低覆盖率地区)进行,结果显示,PCV13接种组儿童疫苗型血清型(VTs)携带率显著低于未接种组:6B(7.0% 对 2.7%,P < 0.01)、6A(4.2% 对 1.2%,P < 0.05)和23F(2.2% 对 0.3%,P < 0.05)。PCV13高覆盖率地区菌株对青霉素、头孢呋辛、红霉素、阿奇霉素、克林霉素及磺胺甲噁唑等药物上的非敏感性明显低于低覆盖率地区,同时多重耐药比例也明显降低。
文字撰稿:潘张旸
审核校对:张馨予
排版编辑:刘子祺
参考文献:
1. Walker, C. L. F., Rudan, I., Liu, L., Nair, H., Theodoratou, E., Bhutta, Z. A., O’Brien, K. L., Campbell, H., & Black, R. E. (2013). Global burden of childhood pneumonia and diarrhoea. Lancet (London, England), 381(9875), 1405–1416. https://doi.org/10.1016/S0140-6736(13)60222-6
2. Lewnard, J. A., Lo, N. C., Arinaminpathy, N., Frost, I., & Laxminarayan, R. (2020). Childhood vaccines and antibiotic use in low- and middle-income countries. Nature, 581(7806), 94–99. https://doi.org/10.1038/s41586-020-2238-4
3. Andrejko, Kristin, et al. “Antimicrobial resistance in paediatric Streptococcus pneumoniae isolates amid global implementation of pneumococcal conjugate vaccines: a systematic review and meta-regression analysis.” The Lancet Microbe 2.9 (2021): e450-e460.
4. Dissanayake, G., Zergaw, M., Elgendy, M., Billey, A., Saleem, A., Zeeshan, B., … & Zergaw, M. F. (2024). Effectiveness of Pneumococcal Conjugate Vaccines Over Antibiotic-Resistant Acute Otitis Media in Children: A Systematic Review. Cureus, 16(8).
5. Dagan, R., & Klugman, K. P. (2008). Impact of conjugate pneumococcal vaccines on antibiotic resistance. The Lancet. Infectious diseases, 8(12), 785–795. https://doi.org/10.1016/S1473-3099(08)70281-0
6. Huang, Susan S., et al. “Continued impact of pneumococcal conjugate vaccine on carriage in young children.” Pediatrics 124.1 (2009): e1-e11.
7. Fenoll, A., et al. “Temporal trends of invasive Streptococcus pneumoniae serotypes and antimicrobial resistance patterns in Spain from 1979 to 2007.” Journal of clinical microbiology 47.4 (2009): 1012-1020.
8. Van Effelterre, Thierry, et al. “A dynamic model of pneumococcal infection in the United States: implications for prevention through vaccination.” Vaccine 28.21 (2010): 3650-3660.
9. 肺炎球菌性疾病免疫预防专家共识(2020版)[J].中国疫苗和免疫,2021,27(01):1-47. DOI:10.19914/j.CJVI.2021001.
10. 吕葛,董方,吕志勇.北京某儿童医院肺炎链球菌临床分离情况及其耐药性[J].检验医学,2024,39(11):1122-1127.
11. 吕婧雯,田本顺,银晓聪,赵云虎,刘素玲,杨结仪,张娇,肖云菊,顾兵.2012—2020年广州地区肺炎链球菌耐药趋势增高及聚集性多重耐药模式[J].南京医科大学学报(自然科学版),2022,42(06):854-860.
12. Li Y, Wang S, Hong L, Xin L, Wang F, Zhou Y. Serotype distribution and antimicrobial resistance of Streptococcus pneumoniae in China among children under 14 years of age post-implementation of the PCV13: a systematic review and meta-analysis (2017-2024). Pneumonia (Nathan). 2024;16(1):18. Published 2024 Oct 5. doi:10.1186/s41479-024-00141-z
13. Wang, Jian, et al. “Different patterns of antimicrobial non-susceptibility of the nasopharyngeal carriage of Streptococcus pneumoniae in areas with high and low levels of PCV13 coverage.” Vaccine 62 (2025): 127455.





