PCV13
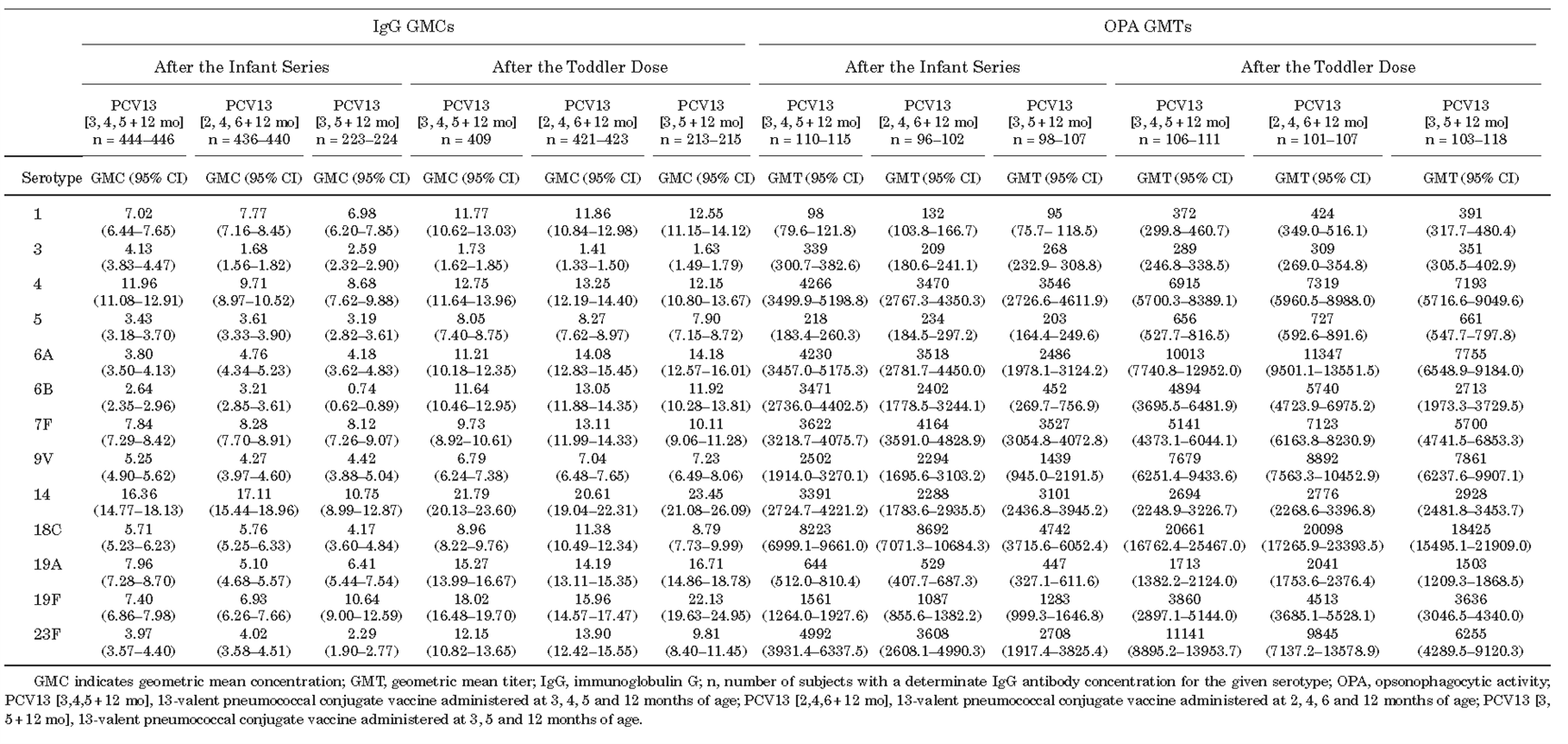
一项纳入1196例婴儿的临床试验研究发现,在健康的中国婴儿中,采用3剂或2剂接种策略完成婴儿期PCV13基础免疫,随后在幼儿阶段接种1剂次加强针,具有免疫原性和良好的耐受性,并对PCV13覆盖的血清型具有保护作用。然而,对于某些血清型(如6B、14、18C 和 23F),两剂的IgG几何平均浓度(GMC)较低[1](表1、2)。
表1 婴儿系列接种及幼儿剂量接种1个月后IgG应答者百分比(IgG ≥0.35 µg/mL)和调理吞噬活性(OPA)应答者百分比(几何平均滴度(geometric mean titers,GMT)≥检测下限)
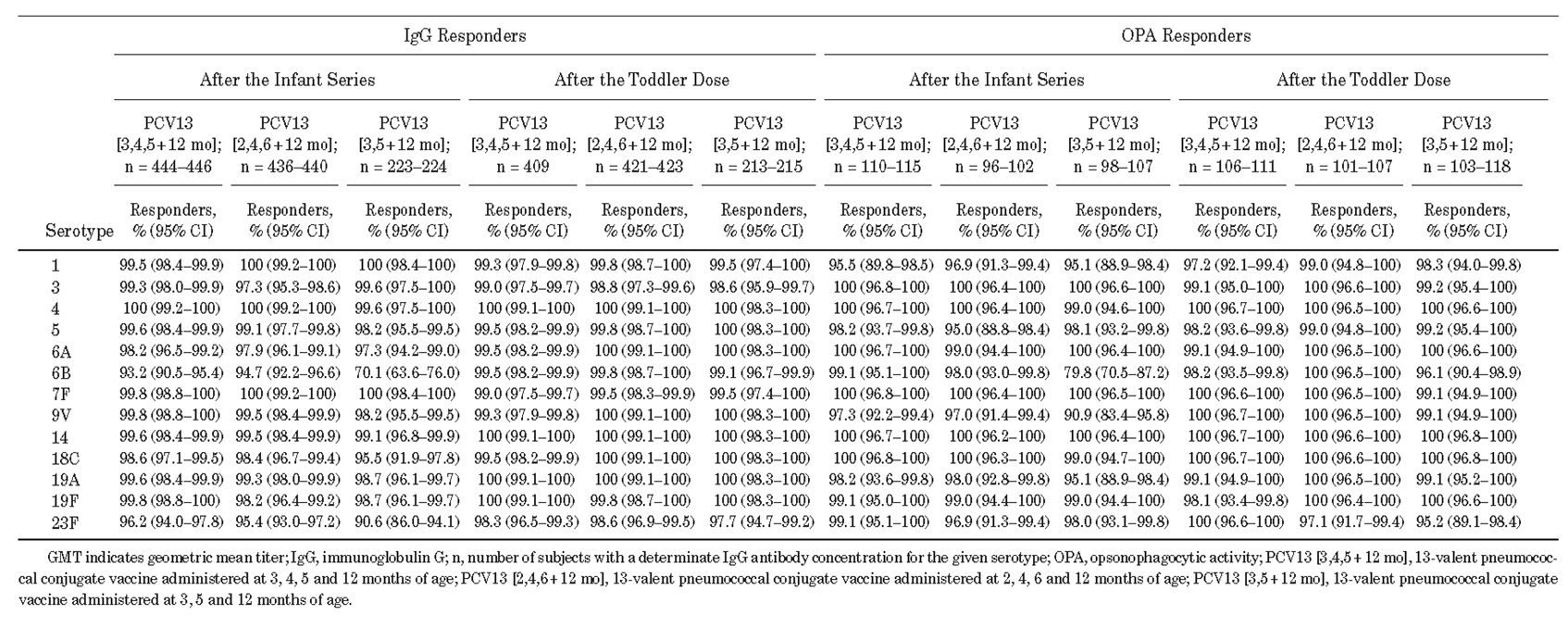
表2 PCV13接种者在婴儿系列和幼儿剂量接种1个月后的IgG GMCs和OPA GMTs
另一项临床研究分析了PCV13在未接种过PPSV23的成年人群(年龄在18-49岁)中的免疫反应。该研究纳入1316例研究对象的按年龄分组临床研究发现,最年轻的亚组(18-29岁)的免疫反应最强[2]。与 60-64岁成年人相比,18-49 岁成年人更容易出现局部反应和全身反应,并且是自限性的。18-49岁受试者所有血清型(血清型3除外)的OPA(调理吞噬活性)GMT均显著高于60-64岁受试者。最年轻的亚组(18-29岁)中OPA GMT最高;而在60-64岁成年人中OPA GMT最低。除血清型3、5、7F、9V和18C外,18-49岁成年人的所有血清型IgG-GMCs均显著高于60-64岁的成年人。对于18-49岁成年人,接种后1年所有血清型OPA GMTs均显著高于接种前。在所有年龄组和亚组中,OPA GMTs在接种疫苗前、接种疫苗1个月后和接种疫苗1年后的测量的抗体反应曲线表明,所有血清型在接种疫苗1个月后的反应均高于接种前;免疫反应在1年后有所减弱,但仍高于接种前滴度。除血清型3外,18-49岁成年人的所有血清型OPA反应曲线均高于60-64岁成年人。在亚组中,18-29岁成年人的OPA反应曲线最高,而40-49岁成年人的OPA反应曲线最低[2]。
此外,该研究发现与60-64岁的受试者相比,18-49岁的受试者更容易出现红肿、疼痛和手臂活动受限。注射部位疼痛是最常见的局部反应,每个年龄组中有80%以上的受试者出现该反应。18-49岁和60-64岁受试者中,分别有15.6%和1.7%的人出现严重疼痛(定义为无法将手臂抬过肩膀)。两组受试者局部反应的平均持续时间均≤3天。最常见的全身性反应是新出现的全身肌肉疼痛、头痛和疲劳。除发热外,18-49岁的受试者全身性反应发生率高于60-64岁的受试者。全身性反应的平均持续时间小于6天。在18-49岁和60-64岁的受试者中,接种疫苗后1个月内记录的不良事件发生频率相似,其中感染和侵染是两组人群中最常报告的不良事件。在18-49岁的受试者中,最常见的不良事件为恶心、上呼吸道感染、鼻咽炎和腹泻[2]。
瑞典一项临床研究也发现接种PCV13疫苗不良反应多为局部反应,且严重程度多为轻度或中度的触痛、压痛或发热,最常见的不良事件是感染和侵染(最常见的为鼻咽炎和胃肠炎),其次是胃肠道功能紊乱[3]。
Meta分析结果显示:PCV13疫苗与其他肺炎球菌结合疫苗相比,产生的压痛症状少,肿胀症状和发烧症状多,发红症状、食欲减退症状及易怒症状无统计学差异[4]。
研究发现,PCV13于6周龄开始基础免疫的免疫程序在婴幼儿中具有良好的免疫原性、有效性和安全性[5]。此外,6周龄开始PCV13基础免疫的免疫程序对儿童及成人均具有较好的保护效果,可显著降低儿童及成人侵袭性肺炎球菌性疾病(IPD)的发病率,减少儿童及成人肺炎球菌的鼻咽部定殖率,降低肺炎球菌的耐药性[5]。
也有研究关注不同免疫程序免疫原性比较,如研究发现儿童按照2p(2剂基础免疫)或3p(3剂基础免疫)免疫程序完成肺炎球菌多糖结合疫苗(Pneumococcal Polysaccharide Conjugate Vaccine,PPCV)的全程接种后,均能获得较好的抗体阳转率( Antibody Positive Rate,APR),但2p免疫程序对血清型6B和23F抗原仍无法产生良好的免疫应答[6]。除6B血清学抗原外,采用2p+1和3p+1免疫程序全程接种PPCV后的免疫学效果并无显著差异;建议我国和其他IPD高发地区在基础免疫阶段采用3剂基础免疫程序[6]。
PCV13与PPV23比较
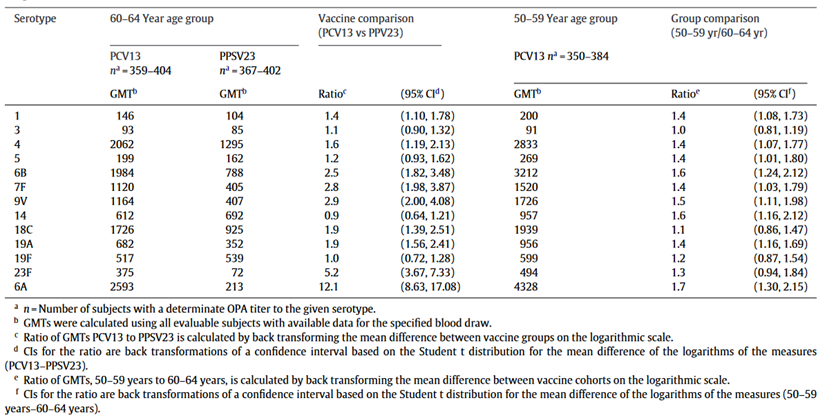
美国一项纳入1234名受试者的临床试验,比较了接种单剂PCV13和PPV23在未接种过肺炎疫苗的成人中的免疫反应。研究发现PCV13比PPV23诱导更强的免疫应答,提示PCV13在预防疫苗型肺炎球菌感染方面具有比PPV23更强的免疫优势[7]。在60-64岁受试者中,PCV13组接种后第1个月的OPA GMTs在统计学上显著高于PPV23组(表3)。对于PCV13覆盖的大多数血清型,PCV13比PPV23诱导更强的免疫应答,表明PCV13在预防疫苗型肺炎球菌感染方面比PPV23具有免疫学优势。与60-64岁的成年人相比,50-59岁的成年人对PCV13的免疫反应通常更强。两种疫苗接种后抗体水平随时间缓慢下降,但1年后仍是接种前水平的两倍。在接种4-7年后,抗体水平降至疫苗接种前水平以下。在60-64岁的受试者中,PPV23治疗后注射部位出现严重疼痛的受试者百分比显著高于PCV13,而PCV13接种后出现轻微疼痛的受试者百分比显著高于PPV23。与老年组相比,50-59岁的PCV13受试者报告疼痛和手臂活动受限的比例较高,PCV13组和PPV23组之间未观察到全身症状的显著差异。在PCV13(17.0%)和PPV23(16.7%)受试者中,不良事件的发生率相似。大多数不良事件包括老年人中常见的疾病和情况,感染性疾病是所有组中最常报告的不良事件类型[7]。
表3 60-64岁受试者接种PCV13和PPV23 1个月后和50-59岁受试者接种PCV13 1个月后肺炎球菌OPA GMT的比较
上述临床试验团队进行了另外一项研究,在受试者接种疫苗后的四年随访中,最初接种PCV13的60-64 岁人群又接种了PCV13或PPV23,而最初接种PPV23的人群接种了另一种PPV23。所有50-59岁的成年人都重新接种了PCV13。研究团队比较了接种前和接种后一个月不同接种组合策略的OPA GMTs结果:在50-64 岁的成年人中,初次接种PCV13的受试者建立了一种免疫状态,在进一步接种PCV13或PPV23可诱导二次免疫应答。研究还发现,PCV13在较年轻的受试成人组(50-59岁)中产生的免疫应答率更高。如果以适当间隔接种PCV13,免疫应答会持续,并可能在之后通过接种PPV23扩大对非PCV13血清型的免疫应答。相比之下,初次接种PPV23后,再次接种PPV23产生的免疫应答通常较低[8]。在另一项关联研究中,研究团队发现,在 60-64 岁未接种过肺炎球菌疫苗的成年人中,初次接种 PCV13 可增强对随后接种 PPSV23 的抗肺炎球菌反应,这两种疫苗中的许多血清型具有共通性。 与此相反,初次接种 PPSV23 会降低随后接种 PCV13 对所有血清型的反应。 在两次接种间隔相对较短的一年时间内,与首次接种 PCV13 相比,第二次接种 PCV13(PCV13/PCV13)或 PPSV23(PCV13/PPSV23)后,大多数血清型的应答效果都不差[9] 。
PPV23
巴西开展的一项队列研究发现[10],PPV 23接种一个月后,IgG-GMCs显著高于接种前,接种1年后,除血清型5外,其余抗体浓度仍显著高于接种前。血清型5接种1年后的抗体浓度值与接种前的水平相当。此外,在所有时间点,男性IgG平均浓度均高于女性。
中国一篇关于PPV23的系统综述发现[11],PPV23对于免疫抑制人群如骨髓或器官移植、炎症性肠病、血液肿瘤、慢性肝病、正在使用免疫抑制治疗、慢性肾或呼吸道疾病患者,疫苗应答均会减弱,但对于有基础疾病但无免疫抑制人群,如无脾、实体肿瘤、用TNF-a抑制治疗、风湿病、糖尿病病例和年纪较大的健康老人中,疫苗应答不会减弱[12]。中国的一项研究表明,慢性阻塞性肺病患者接种一剂 PPSV23 有良好的免疫原性,接种 4 周后抗体水平提高了两倍,从 65.2%(血清型 3)增至 94.4%(血清型 2)[13]。 美国的一项研究发现,在慢性阻塞性肺病患者中,PCV7 可能比 PPV23 诱导更强的功能性抗体反应,这种反应可能在接种后持续 2 年[14]。
我国一项在2岁以上人群中开展的PPV23免疫原性研究表明,PPV23可诱导出明显的免疫应答,23种血清型抗体的2倍增长率在51.49%~97.01%之间,其中8、9N、18C和33F型血清型增长率超过90%[15];社区老年人接种PPV23后特异性抗体IgG几何平均值显著提高[16];>60岁老年人接种PPV23后23种血清型功能性抗体水平明显高于免疫前,有较好的免疫原性,而且PPV23疫苗接种效果不会因接种者年龄的增加而减弱[17]。Miemyk[18]等研究发现,接种PPV23后血清型4、6B、14和19F的几何平均IgG浓度和调理素吞噬活性滴度中值均显著升高。Serpa[19]等研究发现,年龄或重复免疫均不影响中老年人PPV23VH3特异性免疫原性。
在免疫力正常的成人和患有基础疾病但免疫缺陷不严重的人群中,疫苗预防IPD的效果为50%~80%[20],且接种PPV23可以降低肺炎的严重程度和死亡风险。研究表明PPV23预防IPD的效力为52%~74%[21]。研究还发现PPV23接种可明显降低老年人上呼吸道感染的发病,PPV23对肺炎球菌所致呼吸系统感染的保护率在40%~80%[22, 23]。徐英等证实社区老年人,尤其是有COPD、冠心病的老年人,接种PPV23具有一定的保护效率、成本–效益和安全性,对降低老年人下呼吸道感染、减少抗生素使用、降低住院的保护效率分别为69.7%、72.6%、65.9%[24]。
老年人接种PPV23短期内抗体滴度显著提高。但证据显示,尽管抗体水平会随着时间推移降低,IgG和功能抗体水平在成人接种后至少在5-10年内持续高于未接种的成人的水平[25,26]。上海开展的一项老年人接种PPV23效果评价表明[27],老年人接种PPV23后可产生特异性抗体,接种后3个月阳性率最高,可维持6个月。PPV23接种后,可预防IPD的发生,但其保护效力随着时间的增长而下降(接种后<3年效果最好,>5年效果较差)[28]。接种PPV23后半年内肺炎疫苗保护率为87.44%,接种疫苗后1年内肺炎疫苗保护率为85.83%[29]。
上海一项针对 60-70 岁人群再次接种 PPV23 的免疫原性和安全性的研究发现,免疫接种后,再次接种组的总抗体 GMI 低于首次接种组。 再次接种组所有血清型的 GMI 均低于首次接种组[30]。
中国上海的一项研究发现[31],PPV23在60岁及以上老年人群中大规模使用的安全性好。2013—2017年,AEFI(Adverse Event Following Immunization,疑似预防接种异常反应)报告发生率为33.04/10万剂,远低于2016年全国AEFI监测数据中PPV23报告发生率(129.99/10万剂),所有不良反应病例的临床转归较好,绝大多数异常反应很快治疗痊愈。
中国有关PPV23安全性评价的研究显示[32],2010—2015年广州市AEFI发生率为39.13/10万剂。一般反应以发热、红肿为主。此外,还监测到过敏性皮疹、热性惊厥、血管性水肿等异常反应,其中严重异常反应5例(热性惊厥),所有异常反应均好转或治愈。未发现罕见和极罕见不良反应。该研究亦发现广州市PPV23的接种人群主要是儿童,老年人群接种率较低。
部分关于PPV23与流感疫苗的联合效用的研究
中国江苏一项纳入1035例对象的临床试验发现[31],联合接种PPV23和流感病毒裂解疫苗(TIV)不影响肺炎球菌多糖疫苗的免疫效果。疫苗接种后的不良反应发生率为15.9%。局部不良反应多为疼痛、肿胀、红肿等,全身不良反应多为体温异常、恶心、腹泻等,经对症治疗后,均痊愈。研究提示,联合组的PPV23和TIV均具有良好的免疫原性和安全性,可以同时接种。
中国山东省日照市一项纳入339例研究对象的队列研究发现[32],疫苗组(联合接种过PPV23和流行性感冒(流感)病毒裂解疫苗(Split-Virus Influenza Vaccine,InfV-B))和对照组(两种疫苗均未接种)上呼吸道感染疾病发生率分别为5.3%、13.3%,差异有统计学意义。接种PPV23和InfV-B能减少上呼吸道感染的发生率,其保护效率为60%,差异有统计学意义。同时,该研究中接种PPV23和InfV-B及相关总费用为58,739元,接种疫苗效益达236,733.86元。接种疫苗后效益成本比为4.03,接种疫苗后净效益为177,994.86元。研究表明,社区老年人群联合接种PPV23和InfV-B能减少上呼吸系统疾病的发生,具有一定的保护效力,且能获得较高的成本效益。
而另一项关于联合接种反应率的研究显示[30],所有观察对象、单独接种流感疫苗组、单独接种国产PPV23组、单独接种进口PPV23组、联合接种组Ⅰ(流感与国产PPV23联合接种)、联合接种组Ⅱ(流感与进口PPV23联合接种)预防接种反应发生率分别为10.13%、5.35%、11.63%、9.52%、17.24%和12.63%,均以局部反应、注射部位疼痛、轻度反应为主。反应均在7d内出现,且主要发生在接种后30分钟~1天时间内(82.61%);反应发生后均在7d内恢复,绝大多数在1d内恢复(84.78%)。结果提示,联合接种组反应发生率相对单独接种组反应发生率高。相对于单独接种疫苗组反应发生率方面,国产PPV23组高于进口PPV23组高于流感组,但差异无统计学意义(P>0.05);使用国产PPV23的联合接种组反应发生率高于使用进口PPV23的联合接种组,但差异无统计学意义(P>0.05)。
审核校对:李周蓉 张馨予 潘张旸 郭磊
文献编辑:张翯昱 刘子祺
网页编辑:祖嘉琦
参考文献
- Zhu, F., Hu, Y., Li, J., Ye, Q., Young, M. M., Liang, J. Z., … Scott, D. A. (2019). Immunogenicity and Safety of the 13-Valent Pneumococcal Conjugate Vaccine Administered in a 3 + 1 versus 2 + 1 Dose Schedule Among Infants in China. The Pediatric Infectious Disease Journal, 38(11), 1150–1158
- Bryant K A,Frenck R,Gurtman A, et al. Immunogenicity and safety of a 13-valent pneumococcal conjugate vaccine in adults 18-49 years of age,naive to 23-valent pneumococcal polysaccharide vaccine .Vaccine, 2015, 33: 5854-5860.
- Silfverdal Sven Arne,Flodmark Carl-Erik,Rombo Lars et al. 13-Valent pneumococcal conjugate vaccine (PCV13) in children partially immunized with 7-valent pneumococcal conjugate vaccine (PCV7): a phase 3, open-label trial.[J] .Vaccine, 2013, 31: 1284-92.
- 孙嘉璐,唐倩如,王海滨.13价肺炎球菌多糖结合疫苗安全性的meta分析.实用预防医学,2019,26(07):871-873.
- 李燕,安志杰,王华庆.6周龄开始13价肺炎球菌结合疫苗基础免疫免疫原性、安全性及效果分析.中国公共卫生,2018,34(11):1491-1495.
- Hu Y, Tang X, Guo J, Chen Y, Shen L. The Meta-Analysis of Immunological Effects of Pneumococcal Polysaccharide Conjugate Vaccine Following Different Immunization Schedules. Chinese Journal of Vaccines and Immunization,2014,20(03):245-249+278.
- Jackson, L. A., Gurtman, A., Van Cleeff, M., Jansen, K. U., Jayawardene, D., Devlin, C., Scott, D. A., Emini, E. A., Gruber, W. C., & Schmoele-Thoma, B. (2013). Immunogenicity and safety of a 13-valent pneumococcal conjugate vaccine compared to a 23-valent pneumococcal polysaccharide vaccine in pneumococcal vaccine-naive adults. Vaccine, 31(35), 3577–3584. https://doi.org/10.1016/j.vaccine.2013.04.085
- Jackson L A, Gurtman A, van Cleeff M, et al. Influence of initial vaccination with 13-valent pneumococcal conjugate vaccine or 23-valent pneumococcal polysaccharide vaccine on anti-pneumococcal responses following subsequent pneumococcal vaccination in adults 50 years and older[J]. Vaccine, 2013, 31(35): 3594-3602.
- Greenberg, R. N., Gurtman, A., Frenck, R. W., Strout, C., Jansen, K. U., Trammel, J., Scott, D. A., Emini, E. A., Gruber, W. C., & Schmoele-Thoma, B. (2014). Sequential administration of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine in pneumococcal vaccine–naïve adults 60–64 years of age. Vaccine, 32(20), 2364–2374. https://doi.org/10.1016/j.vaccine.2014.02.002
- Brandão Angela Pires,de Oliveira Tânia Cristina,de Cunto Brandileone Maria Cristina et al. Persistence of antibody response to pneumococcal capsular polysaccharides in vaccinated long term-care residents in Brazil.[J] .Vaccine, 2004, 23: 762-8.
- 许玉洋,刘艳,安志杰.老年肺炎球菌多糖疫苗免疫反应和保护效果研究进展[J].中国公共卫生,2021,37(04):584-588.
- Agarwal N, Ollington K, Kaneshiro M, Frenck R, Melmed GY. Are immunosuppressive medications associated with decreased responses to routine immunizations? A systematic review. Vaccine. 2012 Feb 14;30(8):1413-24. doi: 10.1016/j.vaccine.2011.11.109.
- Li, Y., Ma, Y., An, Z., Yue, C., Wang, Y., Wang, L., Liu, Y., Yuan, X., Zhang, S., Ye, Q., Li, H., Li, K., Yin, Z., & Wang, H. (2021). Immunogenicity of 23-Valent Pneumococcal Polysaccharide Vaccine in Patients with Chronic Obstructive Pulmonary Disease – Hebei Province, China, September-December, 2019. China CDC weekly, 3(16), 331–334. https://doi.org/10.46234/ccdcw2021.089
- Dransfield MT, Harnden S, Burton RL, et al. Long-term comparative immunogenicity of protein conjugate and free polysaccharide pneumococcal vaccines in chronic obstructive pulmonary disease. Clinical Infectious Diseases : an Official Publication of the Infectious Diseases Society of America. 2012 Sep;55(5):e35-44. DOI: 10.1093/cid/cis513.
- Kong Yl, Zhang W, Jiang ZW, et al. lmmunogenicity and safety ofa 23-valent pneumococcalpolysaccharide vaccine inhinesehealthy population aged > 2 years: a randomized, double-blindedactive control, phase Il trial[J]. HumanVaccines andImmunotherapeutics, 2015,11(10):2425 -2433
- 冯佳声.社区老年人接种23价肺炎球菌多糖疫苗的效果及因素分析 [J].心电图杂志: 电子版,2018,7(2):166-167.
- 杨宗勇.60岁以上老年人接种23价多糖肺炎球菌疫苗的安全性和接种前后免疫原性结果分析[.心理月刊,2019,14(12):16-18.
- Miernyk KM, Butler IC, Bulkow LR, et al. Immunogenicity andreactogenicity of pneumococcal polysaccharide and conjugatevaccines in Alaska native adults 55-70 years of age[J]. ClinicalInfectious Diseases,2009,49(2): 241 -248.
- Serpa JA, Valayam J, Musher DM, et al. V;3 antibody response toimmunization with pneumococcal polysaccharide vaccine111middle-aged and elderly persons[J].Clinicaland VaccineImmunology,2011,18(3):362-366.
- Centers for Disease Control and Prevention (CDC), Advisory Committee on Immunization Practices. Updated recommendations for prevention of invasive pneumococcal disease among adults using the 23-valent pneumococcal polysaccharide vaccine (PPSV23)[J]. Morbidity and Mortality Weekly Report, 2010, 59(34):1102–1106
- Moberley S, Holden J, Tatham DP, et al. Vaccines for preventing pneumococcal infection in adults[J]. Cochrane Database of Systematic Reviews, 2008(1): CD000422.
- 高洁, 何永频, 沈冰, 等. 上海市静安区 60 岁以上老年人接种 23 价肺炎球菌多糖疫苗效果评估 [J]. 疾病监测, 2015, 30(7): 582 – 584.
- 杨佳平, 杨兴堂, 李晓军, 等. 上海市宝山区老年人接种 23 价肺 炎球菌多糖疫苗后的效果观察 [J]. 上海预防医学, 2017, 29(12): 945 – 948.
- Dong, B. R., Xu, Y., Zhang, Y. L., & Yue, J. R. (2005). Efficacy and safety of 23-valent pneumococcal polysaccharide vaccine in prevention of lower respiratory tract infections in the Chinese elderly: A prospective concurrent controlled trial. Chest, 128(4). https://doi.org/10.1378/chest.128.4_meetingabstracts.148s
- Grabenstein, J. D., & Manoff, S. B. (2012). Pneumococcal polysaccharide 23-valent vaccine: Long-term persistence of circulating antibody and immunogenicity and safety after revaccination in adults. Vaccine, 30(30), 4435–4444. https://doi.org/10.1016/j.vaccine.2012.04.052
- Guo X, Li J, Qiu J, Zhang R, Ren J, Huang Z, Li Z, Liang X, Lan F, Chen J, Huang F, Sun X. Persistence of antibody to 23-valent pneumococcal polysaccharide vaccine: a 5-year prospective follow-up cohort study. Expert Rev Vaccines. 2024 Jan-Dec;23(1):237-245. doi: 10.1080/14760584.2023.2296934. Epub 2024 Feb 19. PMID: 38369970.
- 李晓军, 赵世莹, 杨佳平, 朱江, 张迈月, 张月娟. 上海市某区老年人接种23价肺炎球菌多糖疫苗效果评价[J]. 上海预防医学, 2019, 31(4): 259-263. DOI: 10.19428/j.cnki.sjpm.2019.19319
- Shapiro ED, Berg AT, Austrian R, et al. The protective efficacy of polyvalent pneumococcal polysaccharide vaccine[J]. The New England Journal of Medicine, 1991, 325(21): 1453 – 1460
- 江燕, 庞红, 张泽申, 等. 上海市长宁区社区老年人接种肺炎疫苗 后免疫效果评估 [J]. 职业与健康, 2016, 32(20): 2819 – 2822.
- Qiu, J., Li, Z., Huang, F., Huang, Z., Liang, X., Li, J., Liao, Y., Guo, X., & Sun, X. (2025). Immunogenicity and safety study of 23-valent pneumococcal polysaccharide vaccine revaccination among elderly individuals aged 60–70 years in Shanghai, China. Frontiers in Immunology, 16. https://doi.org/10.3389/fimmu.2025.1623611
- 郭翔,仇静,任佳,刘捷宸,孙晓冬.2013—2017年上海市60岁及以上老年人群大规模接种23价肺炎球菌多糖疫苗的安全性评价.中华预防医学杂志,2020,54(09):929-933.
- 陈健,许建雄,张春焕,谭慧峰,李志群.2010—2015年广州市23价肺炎球菌多糖疫苗接种情况及安全性分析[J].中华微生物学和免疫学杂志,2016,36(05):380-383.
- 汪志国,孙翔,张岷,汤奋扬,马福宝,许燕,胡冉,马燕丽,肖艳慧,陈海平,罗林云.3~7岁儿童同时接种23价肺炎球菌多糖疫苗和流感病毒裂解疫苗的免疫原性及安全性研究.中华微生物学和免疫学杂志,2019(10):758-762.
- 王茂慈,王太平,杨绍明,潘红,张伟,宋艳娟,殷克香,杨晓琳.23价肺炎球菌多糖疫苗和流行性感冒病毒裂解疫苗联合接种对老年人呼吸系统疾病防治效果观察与效益分析.中国疫苗和免疫,2010,16(03):229-232.
- 何奔,向泽林,沈国初,杜哲群,许荣全.老年人单独及联合接种流感疫苗、23价肺炎球菌多糖疫苗的安全性评价.中华微生物学和免疫学杂志,2018,38(04):293-299.





