在中国推广儿童用联合疫苗面临着许多阻碍,其中阻碍之一来源于与现有免疫程序的冲突。这一阻碍还可被细分为二,一是中国国家免疫规划尚未纳入b型流感嗜血杆菌相关疫苗,二是含乙肝抗原成份的联合疫苗,其免疫程序与我国现行乙肝单价疫苗免疫程序有所冲突。
中国国家免疫规划自1978年推出以来,从最初的四种疫苗预防六种疾病发展到了十四种疫苗预防十五种疾病。但从2007年起,国家免疫规划已有15年未进行扩容,有4种世界卫生组织推荐应纳入所有国家免疫规划的疫苗未被纳入,这其中就包括b型流感嗜血杆菌(Hib)疫苗。值得注意的是,在世卫组织194个成员国中,将b型流感嗜血杆菌(Hib)疫苗纳入免疫规划的国家比例为99%,我国是全球唯一未将该疫苗纳入国家免疫规划的世卫组织成员国1。
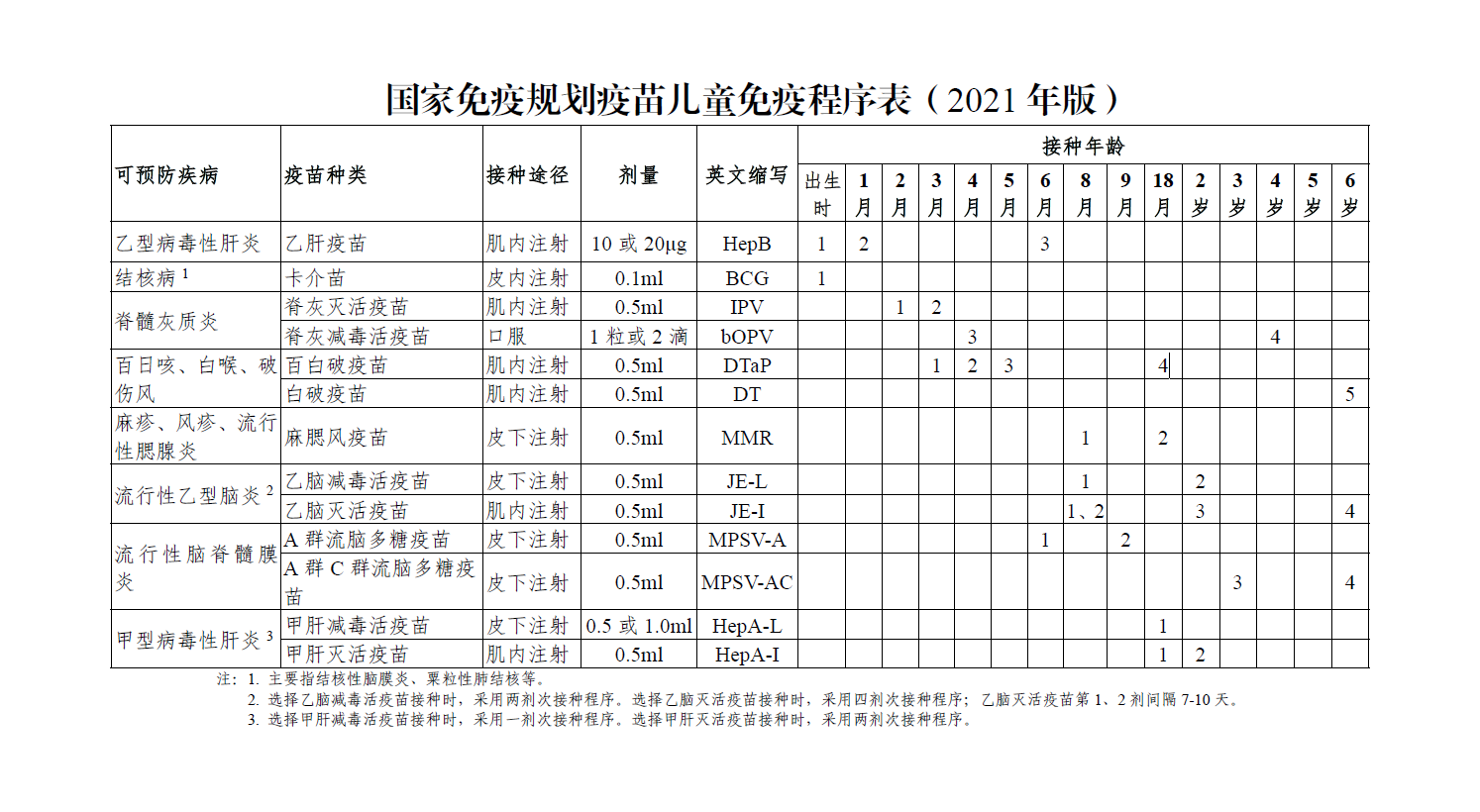
数据来源:https://www.chinacdc.cn/nip/kyjz/mycxbjsm/mycxb/202105/t20210513_230543.html
我国常见的非免疫规划疫苗主要分为两大类。第一类为替代性非免疫规划疫苗,这类疫苗具有与已经纳入免疫规划疫苗不同的特性或者接种程序,例如,儿童用四联、五联疫苗可实现免疫规划内的百白破、脊髓灰质炎及b型流感嗜血杆菌的合并接种;第二类为补充性非免疫规划疫苗,这类疫苗被用于预防国家免疫规划疫苗还未纳入的疾病,b型流感嗜血杆菌(Hib)单价疫苗就属于这一范畴2。
国家免疫规划专家咨询委员会虽然提出将包括b型流感嗜血杆菌疫苗等重点疫苗优先纳入扩大免疫规划的备选范围,但决定扩容需要考虑的因素较多,包括地方疾病负担、财政情况和居民自付水平等。因此,目前将b型流感嗜血杆菌单价疫苗、含b型流感嗜血杆菌成分的联合疫苗(如儿童用四联苗、五联苗)等其他重点疫苗纳入中国国家免疫规划的循证决策进展较为缓慢,大力推广联合程度较高的儿童用联苗也因此受到限制3。
从免疫规划设计角度出发,部分含乙肝抗原成份的儿童用联合疫苗在我国难以推广,在于其免疫程序与我国现行的乙肝单价疫苗免疫程序存在一定冲突。
多项研究及临床指南证实,新生儿在出生后及时接种首针乙肝单价疫苗是阻断乙肝病毒母婴传播的关键4,5,6。我国于1985年引进乙肝单价疫苗,随着疫苗覆盖增加,全国乙肝感染率逐渐降低7。在乙肝单价疫苗纳入中国国家免疫规划后,五岁以下儿童中慢性乙肝病毒感染率从9.7%下降到了不到1%8。由此可见,为新生儿及时接种乙肝单价疫苗尤为重要。
按照我国现行免疫程序,乙肝单价疫苗的接种程序分别在婴儿出生时、一月、六月龄时注射共三剂疫苗,而含有乙肝成分的联合疫苗(如六联疫苗)的免疫程序较为灵活,可以分别在六周、十周、十四周龄或二月、三月、四月龄等时间节点进行三个剂次的基础免疫。推广含有乙肝成分的联合疫苗,还需要评估推迟第二剂次接种对乙肝疫苗免疫原性和防控效果的影响,接种多剂乙肝疫苗的安全性,和交替使用乙肝单价疫苗和含有乙肝抗原成分联合疫苗的问题。
针对第一点,国内外有多项研究表明,推迟接种第2剂次乙肝疫苗不但不会影响疫苗的免疫原性,还会在一定程度上提升乙型肝炎表面抗体(抗 – HBs)水平9,10,11,12。
我国更有研究表明,即使母亲为乙型肝炎表面抗原(HBsAg)和/或乙型肝炎E抗原(HBeAg)单阳或双阳性,推迟第二剂次乙肝疫苗最多六十天都不会影响乙型肝炎表面抗体(抗 – HBs)水平和阳性率13,14。
针对第二点,乙肝疫苗为灭活疫苗,具有优越的安全性15。国外研究和世卫组织立场文件指出,接种额外剂量或剂次的乙肝疫苗后会导致反应原性显著增加的风险很小,人体不会因此受到伤害16,17。
对于最后一点,推广含有乙肝成分的联合疫苗需要解决潜在的免疫程序冲突问题。其实在许多国家,经过儿科医生评估,有感染乙肝病毒风险的新生儿将会搭配接种乙肝单价疫苗和含有乙肝成分的儿童用联合疫苗。
例如在英国,感染乙型肝炎的母亲所生的大多数婴儿在出生后至12个月期间将接受总共六剂疫苗来预防乙型肝炎病毒感染。其中三剂疫苗是免疫规划中所涵盖的六联疫苗,分别在8、12和16周大时接种。另外,这些婴儿会在出生时、4周及12个月龄时分别接种三个剂次的乙肝单价疫苗18。
如果婴儿是由乙肝阴性母亲所生,但将与另一个乙肝感染者一起生活,并有被感染的直接风险,这类婴儿将需要在出院前接种一剂单乙肝单价疫苗,并将从8周开始遵循常规免疫接种计划18。
在2017年发布的立场文件中,世界卫生组织也提出了将乙肝单价疫苗和含有乙肝成分的联合疫苗交替使用的建议。世界卫生组织推荐,如果选择遵循共三剂次的免疫程序,可以在婴幼儿出生时注射一剂单价疫苗,并在注射第一和第三剂次含百白破成分的疫苗时同时接种第二和第三剂次的乙肝单价疫苗或含有乙肝成分的联合疫苗;如果选择遵循共四剂次的免疫程序,在出生时注射单价疫苗以后,可在接种其他常规儿童用联合疫苗的同时接种三剂乙肝单价或含有乙肝成分的联合疫苗17。
2022年7月之前,我国早期法规规定并不利于企业间合作开发多联多价疫苗。虽然中国药监局在2022年7月发布了《疫苗生产流通管理规定》,这为不同企业间合作开发多联多价疫苗提供了一定可能性,但该规定与欧美等国相比,灵活度较低,程序也较为繁琐。在规定发布后,截止目前还未有任何合作开发的多联疫苗相关研发项目落地。
上市许可持有人(MAH)制度是在国际上药品行业被广泛采用的制度,它强调了在药品全生命周期中,上市许可持有人所需要承担的法律责任,并由此实现集约化管控。采取MAH制度,使得不具备相应生产资质的研发机构、自然人等主体,可以通过合作研发或者委托生产的方式获取上市许可资质,这不仅有利于药品的创新研发,优化行业资源配置,还能为提升行政监管带来改观。
中国的药品MAH制度在2015年8月被首次提出,在2015年下半年,一系列与MAH制度的相关政策法规相继出台,并于2019年被正式写入新《药品管理法》,当年12月1日起,中国在全国范围内推广实施药品上市许可持有人制度19。
在这之前,MAH制度已在欧、美、日等地区国家实施多年。欧美实行上市许可与生产许可相互独立的制度,允许申请人和上市许可持有人是不同主体。在我国则不同,虽然在新《药品管理法》分离了生产许可和上市许可,但申请人和持有人仍需为同一主体20。
参照中国《药品管理法》及《疫苗管理法》,中国MAH制度对于申请主体也设置了一定限制,个人无法申请上市许可,只有取得相关产品注册证书的企业或研究机构可以申请。不同的是,欧盟的MAH对于申请主体无任何限制,个人和公司均可申请,欧盟境内授权销售商也具有资格。美国对于申请主体的要求更加宽松,不论是个人、企业、政府机构、学术机构、协会、私人组织还是其他组织都具有申请的条件21。
申请产品范围方面,在中国,进行疫苗委托生产需要经过国家批准,并且在确定受托生产企业后,不得再次转委托生产。而欧盟及美国的MAH制度对产品范围无限制,在委托生产疫苗时无需经过特殊审批环节。因此,在欧美等地区,同一MAH持有的一个或多个疫苗批准文号可由多个生产厂家生产(不同生产厂家可位于多个国家),不同疫苗MAH间可以较为顺畅地合作开发联合疫苗。
在欧洲,当疫苗通过上市许可评审后,欧盟还会颁发疫苗抗原主文件(VAMF)证书,它可以大大简化疫苗上市所需程序22。VAMF为疫苗进行上市许可申请时所需要提供的独立文件,它包括了疫苗包含的每种活性物质的生物学、化学以及药学特质的所有信息。一款疫苗可能含有一个或多个疫苗抗原活性物质。 独立的VAMF可以在申请相同的单价或联合疫苗时使用。在研发新型疫苗时,如联合疫苗的部分疫苗抗原成分与已上市的疫苗抗原成分完全一致,欧盟规定,研发机构可以直接提交之前获颁的VAMF证书。如果所研发的疫苗含有新的活性物质,申请者则需要向当局提供一份针对新活性物质的上市许可申请文件。
而在美国,食品药品监督管理局(FDA)下设了生物制品审评与研究中心(CBER),负责保证生物学治疗安全性与有效性。新生物学医疗产品,包括疫苗,在上市前需要经历类似于药品的申请审评程序。而CBER允许通过“一事一议”的方式,与申请人讨论在联合疫苗申请上市时使用已上市成分的技术资料23。
疫苗研发角度
一些现存研究指出,国外生产联合疫苗时使用单独纯化工艺,而我国在生产百白破联合疫苗时,使用的是共纯化工艺,在生产过程中可能会将硫柳汞作为防腐剂或灭活剂添加,但硫柳汞会破坏脊髓灰质炎疫苗中的有效成分24。
一项研究结果显示,除流感疫苗和水痘疫苗以外,中国家长对于其他非免疫规划疫苗知晓率普遍较低,而在研究涉及的九种非免疫规划疫苗中,被采访的中国儿童家长对于五联疫苗的知晓率最低,仅不到20%25。另有研究人员曾在北京东城区专门收集了针对五联疫苗的信息,在被调查的1月龄儿童监护人183人中,仅有39人知晓五联疫苗,占比为21.31%,而清楚了解五联疫苗能够取代哪些免疫规划疫苗的儿童家长,仅占被访者的10.93%26。
一项2024年的横断面调查研究了中国家长对于DTaP-HBV-IPV-Hib六联疫苗的接受度和支付意愿。来自中国7个城市的581名0-6岁儿童的家长参与了这项调查。研究结果显示在2023年4月28日至6月30日期间,581名家长中的435名家长(74.87%,95% CI: 71.3%-78.4%)表示接受六联疫苗。影响家长疫苗接种决策的主要因素有居住地、家长教育水平、支付疫苗接种费用的经历及疾病知识得分。家长对全程4剂次接种费用的平均支付意愿为2266.66元(SD= 1177.1),中位数为2400元(IQR: 1600-2800)。儿童年龄(p <0.001)、家长教育水平(p =0 .024)以及感知的价格障碍(p <0.001)与支付意愿显著相关。总的来说,家长对六联疫苗的接受度和支付意愿较高。如果家长需自费的金额减少,其接受疫苗的意愿可能会更高。因此,若疫苗被纳入医疗保险覆盖、由政府免费提供或降低其价格,家长的接受度可能会进一步提升27。
在信息的整理、搜集过程中,我们也发现了一些现存证据缺口,这为实施循证决策机制带来一定挑战,具体如下:
- 高质量的中国不同地区疫苗可预防疾病负担数据(发病率、重症率、病死率)
- 受到漏报、监测薄弱、缺乏指导、病例定义不统一等因素影响,现有疾病负担相关数据的准确性有待提高
- 儿童用联合疫苗在中国不同地区的供应情况、需求情况及接种覆盖率
- 现存研究年代较久远、样本量较小、缺乏地区差异性分析
- 儿童用联合疫苗接种的知晓率、知识水平、接种意愿及影响因素分析
- 现有研究参与人数较少,仅有部分研究以非免疫规划疫苗大类入手,缺少针对高效儿童用联合疫苗研究
- 疫苗相关研究
- 儿童用联合疫苗试点项目实施后的经济学评价:不同种类儿童用联合疫苗比较
- 目前暂无高效儿童用联合疫苗相关试点项目
- 疫苗免疫效果评价:儿童用联合疫苗与传统单价或低价疫苗的比较、不同载体的儿童用联合疫苗的比较
- 缺乏六联疫苗相关研究
- 缺乏国产疫苗与进口疫苗效果比较研究
- 免疫接种程序研究:解决免疫程序冲突
- 暂无关于如何解决现行免疫程序与高效儿童用联合疫苗免疫程序二者之间冲突的探讨
- 儿童用联合疫苗与其他疫苗同时接种反应监测
- 缺乏高效儿童用联合疫苗与免疫规划疫苗、或其他常用疫苗的同时接种反应监测相关研究
- 儿童用联合疫苗试点项目实施后的经济学评价:不同种类儿童用联合疫苗比较
- 提高或推广儿童用联合疫苗接种的主要干预策略研究
- 从跨学科角度(包括临床医学、流行病学、社会学、心理学等)推广儿童用联合疫苗接种的策略
审核校对:陈姝、邓添艺、蒋梦露
网页编辑:朱姿颐
参考文献
- 王楠,黎祺,李军宏,王亚敏,马超,郑灿军,尹遵栋.世界卫生组织194个成员国疫苗纳入国家免疫规划现状[J]. 中国疫苗和免疫,2021,27(2):214-220.
- 王文畅等. 中国非免疫规划疫苗接种现状和影响因素浅析. 中国疫苗和免疫. 2020年第1期.
- Ma, C., Li, J., Wang, N., Wang, Y., Song, Y., Zeng, X., Zheng, C., An, Z., Rodewald, L., & Yin, Z. (2022). Prioritization of Vaccines for Inclusion into China’s Expanded Program on Immunization: Evidence from Experts’ Knowledge and Opinions. Vaccines, 10(7), 1010. https://doi.org/10.3390/vaccines10071010
- 夏国良等. 重组乙型肝炎疫苗阻断乙型肝炎病毒母婴传播方案的保护效果评价. 中华流行病学杂志. 2003,24(5):362-364,365
- 中华医学会等. 慢性乙型肝炎基层诊疗指南(2020年). 中华全科医师杂志. 2021,20(2): 137-149. DOI: 10.3760/cma.j.cn114798-20201218-01262
- 中华医学会围产医学分会. 乙型肝炎病毒母婴传播预防临床指南(2020). 临床肝胆病杂志. 2020, 36(7): 1474-1481. DOI: 10.3760/cma.j.cn112141-20200213-00101.
- Cui, F., Shen, L., Li, L., Wang, H., Wang, F., Bi, S., Liu, J., Zhang, G., Wang, F., Zheng, H., Sun, X., Miao, N., Yin, Z., Feng, Z., Liang, X., & Wang, Y. (2017). Prevention of Chronic Hepatitis B after 3 Decades of Escalating Vaccination Policy, China. Emerging infectious diseases, 23(5), 765–772. https://doi.org/10.3201/eid2305.161477
- Liang, X., Bi, S., Yang, W., Wang, L., Cui, G., Cui, F., Zhang, Y., Liu, J., Gong, X., Chen, Y., Wang, F., Zheng, H., Wang, F., Guo, J., Jia, Z., Ma, J., Wang, H., Luo, H., Li, L., Jin, S., … Wang, Y. (2009). Epidemiological serosurvey of hepatitis B in China–declining HBV prevalence due to hepatitis B vaccination. Vaccine, 27(47), 6550–6557. https://doi.org/10.1016/j.vaccine.2009.08.048
- Hadler, S. C., de Monzon, M. A., Lugo, D. R., & Perez, M. (1989). Effect of timing of hepatitis B vaccine doses on response to vaccine in Yucpa Indians. Vaccine, 7(2), 106–110. https://doi.org/10.1016/0264-410x(89)90046-7
- Middleman, A. B., Kozinetz, C. A., Robertson, L. M., DuRant, R. H., & Emans, S. J. (2001). The effect of late doses on the achievement of seroprotection and antibody titer levels with hepatitis b immunization among adolescents. Pediatrics, 107(5), 1065–1069. https://doi.org/10.1542/peds.107.5.1065
- 黄介枚等. 乙型肝炎疫苗纳入计划免疫程序的研究. 中华流行病学杂志. 1992,13(1):1-4.
- 肖敏. 北京市新生儿高剂量乙肝疫苗免疫效果及其影响因素研究. 北京协和医学院中国医学科学院清华大学医学部. 2015.
- 杨进业等. 乙肝疫苗纳入计划免疫(EPI)不同免疫程序的研究[J]. 广西医学. 1994, 16(3): 281-283.
- 陈惠峰等. 新生儿乙肝疫苗第2针接种时间与免疫效果关系研究[J]. 中华流行病学杂志. 1994, 14(6): 349-350.
- 林志强等. 2015-2016年福建省一、二类乙肝疫苗安全性比较. 实用预防医学. 2018(25). Issue (1): 34-36.
- Marcy S. M. (2003). Pediatric combination vaccines: their impact on patients, providers, managed care organizations, and manufacturers. The American journal of managed care, 9(4), 314–320.
- World Health Organization. Hepatitis B vaccines: WHO position paper. Weekly Epidemiological Record, 2017, vol. 92.27.
- University of Oxford. Vaccine Knowledge: 6-in-1 vaccine key facts. Available online: https://vaccineknowledge.ox.ac.uk/6-in-1-vaccine#Key-vaccine-facts. Accessed 20 March 2023.
- 韩恰恰等. 我国药品上市许可持有人制度的实施情况及对策研究. 中国新药杂志. 2019年第5期. 593-597.
- 谢金平等. 药品上市许可持有人 (MAH) 制度对现行监管制度的影响及衔接建议. 中国卫生政策研究. 2018 (11). Issue (12): 1-6. DOI: 10.3969/j.issn. 1674-2982. 2018.12.001
- 鲍鹏等. 中美欧药品注册对照谈: MAH制度并轨与赋能. http://m.cnpharm.com/c/2020-09-29/757774.shtml
- The European Agency for the Evaluation of Medicinal Products (2005). Guideline on requirements for vaccine antigen master file (VAMF) certification. Available online: https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-requirements-vaccine-antigen-master-file-vamf-certification_en.pdf. Accessed 21 March 2023.
- U.S. Department of Health and Human Services Food and Drug Administration Center for Biologics Evaluation and Research (1997). Guidance for industry for the evaluation of combination vaccines for preventable diseases: production, testing and clinical studies. Available online: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/guidance-industry-evaluation-combination-vaccines-preventable-diseases-production-testing-and. Accessed 10 June 2023.
- Sawyer, L. A., McInnis, J., Patel, A., Horne, A. D., & Albrecht, P. (1994). Deleterious effect of thimerosal on the potency of inactivated poliovirus vaccine. Vaccine, 12(9), 851–856. https://doi.org/10.1016/0264-410x(94)90296-8
- 钟小玲等. 儿童家长对第二类疫苗的”知、信、行”情况调查分析. 医药前沿. 2017(12) Vol. 35. Doi: 10.3969/j.issn.2095-1752.2017.35.321.
- 闫威等. 北京市东城区第二类疫苗免疫接种知识调查. 首都公共卫生. 2014(8). No. 4.
- Huang A, Xu X, Tang L, et al. Acceptance and willingness to pay for DTaP-HBV-IPV-Hib hexavalent vaccine among parents: A cross-sectional survey in China. Hum Vaccin Immunother. 2024;20(1):2333098. doi:10.1080/21645515.2024.2333098.





